Parliamoci chiaro, Il BodyBuilding non è soltanto una sottocultura ma anche una scienza. È una scienza multidisciplinare che comprende la fisiologia, la biologia, l’endocrinologia, il metabolismo, la fisiologia cellulare, la genetica, la biologia molecolare e, non dobbiamo dimenticarcene, la farmacologia. La lista dei settori scientifici legati al BodyBuilding è molto lunga.
Personalmente, considero le gare di BodyBuilding una specie di mostra post-sperimentazione. Quando rifletto sulla situazione attuale del BodyBuilding professionistico non posso fare a meno di notare che gli attuali professionisti (o per lo meno quelli d’oltre oceano) riescono a modificare la propria soglia di miglioramento superando sempre i propri limiti: anche se non sono un amante del “più e meglio” preferendo di gran lunga “il giusto per il soggetto”.
Ogni volta che mi ritrovo ad osservare da vicino una competizione di alto livello, essendo anche un preparatore di BodyBuilder, non posso fare a meno di pensare a tutto il tempo, le energie, il cibo, la manipolazione genetica e i farmaci necessari per creare una condizione fisica che arrivi a superare drasticamente il limite genetico. Seguire atleti permettendogli di superare i propri limiti è una manifestazione di dedizione, della giusta applicazione delle conoscenze. Usare i farmaci e la manipolazione genetica per rendere il corpo umano più grosso e più magro non è un esercizio della realizzazione scientifica. È un’espressione della comprensione umana dei settori scientifici precedentemente menzionati così da assumere una sorta di controllo della genetica individuale.
Purtroppo, le riviste scientifiche più importanti non riconoscono il BodyBuilding come un vero e proprio settore della ricerca scientifica. Quindi, per il momento, per raggiungere gli obiettivi noi preparatori e i nostri BodyBuilder ci dobbiamo accontentare di estrapolare le giuste informazioni delle alte sfere della ricerca.
Con l’avvento dei peptidi, questa “sperimentazione” sui Body Builder ha raggiunto livelli impensabili prima degli anni ’90. In questo articolo presenterò un quadro olistico dei “fantastici tre” del mondo dei peptidi, cercando di spiegare esaustivamente la loro natura e le loro azioni. Verranno presentate alcune delle informazioni estrapolate di recente dall’ambiente accademico e applicate al BodyBulding. Ci concentreremo sulla giusta applicazione dell’ormone della crescita (GH), del fattore di crescita insulino-simile 1 (IGF-1) e dell’Insulina per costruire massa muscolare. Queste informazioni verranno presentate in modo da descrivere come questi fattori di crescita possono essere inseriti nelle preparazioni.
I mie non saranno consigli, non riporto tutto ciò al fine di una prescrizione medica generalizzata ma lo faccio per cultura e conoscenza, contro i danni della disinformazione dei “pro-doping” e degli “anti-doping”.
Asse GH/IGF-1
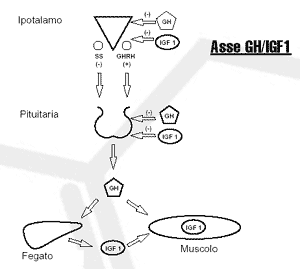 I livelli di GH del corpo sono strettamente regolati da numerose sostanze chimiche che comprendono i macronutrienti, i neurotrasmettitori e gli ormoni. Il segnale per aumentare i livelli di GH del corpo parte dell’ipotalamo. Lì, due ormoni peptidici agiscono insieme per aumentare o diminuire la produzione di GH da parte della ghiandola pituitaria. Questi ormoni sono la somatostatina (SS) e l’ormone rilasciante ormone della crescita (GHRH). La somatostatina agisce nella pituitaria per diminuire la produzione di GH. Il GHRH agisce nella pituitaria per aumentare la produzione di GH. Insieme questi due ormoni regolano, in modo pulsatile, il livello di GH che circola nel corpo.
I livelli di GH del corpo sono strettamente regolati da numerose sostanze chimiche che comprendono i macronutrienti, i neurotrasmettitori e gli ormoni. Il segnale per aumentare i livelli di GH del corpo parte dell’ipotalamo. Lì, due ormoni peptidici agiscono insieme per aumentare o diminuire la produzione di GH da parte della ghiandola pituitaria. Questi ormoni sono la somatostatina (SS) e l’ormone rilasciante ormone della crescita (GHRH). La somatostatina agisce nella pituitaria per diminuire la produzione di GH. Il GHRH agisce nella pituitaria per aumentare la produzione di GH. Insieme questi due ormoni regolano, in modo pulsatile, il livello di GH che circola nel corpo.
Sono molti i fattori che possono influenzare questo equilibrio delicato. Primo, il GH è soggetto a un feedback negativo in riposta al suo stesso rilascio. Il GH, come l’IGF-1, ritorna nell’ipotalamo e nella pituitaria per aumentare il rilascio di SS, diminuendo così il rilascio di GH. Il GH può agire anche in modo autocrino e paracrino (cioè influenzando le cellule sorgente e le cellule circostanti senza dovere entrare in circolazione) all’interno sia dell’ipotalamo che della pituitaria.
Anche i neurotrasmettitori influenzano i livelli di GH nell’ipotalamo. Questo controllo neuroendocrino deve ancora essere chiarito ma alcuni fattori sono già chiaramente coinvolti (vedi tabella)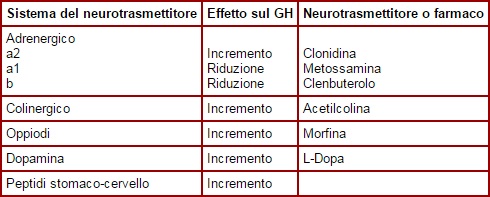 Come di certo saprete, anche l’alimentazione e i fattori metabolici modulano i livelli di GH. Un calo dello zucchero ematico come quello che si verifica durante l’attività fisica o durante il sonno causa un aumento della secrezione del GH. I pasti ricchi di proteine aumentano la secrezione di GH. Alcuni amminoacidi come la L-Arginina sembrano aumentare il GH diminuendo il rilascio di SS dall’ipotalamo. Anche la vitamina Niacina ha mostrato di aumentare del 300-600% il rilascio di GH indotto dall’attività fisica (Murray, 1995).
Come di certo saprete, anche l’alimentazione e i fattori metabolici modulano i livelli di GH. Un calo dello zucchero ematico come quello che si verifica durante l’attività fisica o durante il sonno causa un aumento della secrezione del GH. I pasti ricchi di proteine aumentano la secrezione di GH. Alcuni amminoacidi come la L-Arginina sembrano aumentare il GH diminuendo il rilascio di SS dall’ipotalamo. Anche la vitamina Niacina ha mostrato di aumentare del 300-600% il rilascio di GH indotto dall’attività fisica (Murray, 1995).
In questo studio particolare sono state eseguite 4 prove distinte in cui 10 soggetti hanno pedalato al 68% del VO2 max per 120 minuti seguiti da uno sforzo cronometrato di 5,6 km. Ogni 15 minuti di attività fisica i soggetti hanno ingerito 3,5 ml per chilogrammo di peso corporeo magro di una fra 4 bevande:
- placebo acquoso (WP)
- WP + 280 mg di acido nicotinico 1,1 (WP + NA)
- bevanda al 6% di carboidrati ed elettroliti (CE)
- CE + NA
L’ingestione dell’Acido Nicotinico (WP + NA e CE + NA) smorzava l’aumento degli acidi grassi liberi (FFA) associato al WP e al CE; infatti, l’ingestione dell’acido Nicotinico impediva efficacemente agli FFA di aumentare oltre i valori a riposo. I livelli bassi di FFA con l’ingerimento di Acido Nicotinico sono stati associati a un incremento di 3-6 volte delle concentrazioni di ormone della crescita umano durante l’attività fisica. Resta comunque la domanda se questo aumento significativo ma temporaneo del GH produca un maggiore effetto dell’allenamento. Può creare una maggiore capacità di deposito del glicogeno ma a parte questo non sappiamo niente con certezza.
La riduzione calorica riduce drasticamente i livelli ematici di IGF-1 e contemporaneamente aumenta il rilascio di GH. Questo meccanismo aiuta efficacemente il soggetto ad adattarsi metabolicamente senza dover eseguire azioni anaboliche che potenzialmente accelererebbero la morte per fame. È importante capire che il GH può essere anabolico o catabolico. Quando l’assunzione di nutrienti è alta, la secrezione di GH aumenta producendo anche maggiori livelli di IGF-1, IGFBP3 e insulina. In queste condizioni il ruolo principale del GH è aumentare l’anabolismo attraverso i fattori di crescita locali come l’IGF-1 e l’Insulina.
Anche quando l’assunzione di nutrienti è bassa il GH aumenta ma questa volta non c’è un incremento concomitante di IGF-1, IGFBP3 o Insulina. In presenza di queste circostanze (ipocalorica) il GH agisce come un ormone catabolico che aumenta l’utilizzo dei grassi per produrre carburante risparmiando così il glucosio corporeo senza però influenzare la costruzione muscolare. Questo comportamento dell’asse GH/IGF-1 è parte di quello che rende così difficile costruire massa muscolare durante una dieta con calorie ridotte. Va detto che durante la dieta l’IGF-1 prodotto localmente nei muscoli scheletrici risponde all’allenamento in modo normale. Ciò rende obbligatorio l’uso dei carichi pesanti quando si cerca di prepararsi per una gara senza usare i farmaci. E’ ovvio che stiamo parlando di situazioni endogene e non di alterazione indotta da somministrazioni ormonali esogene.
GH: funzioni e applicazione nel Bodybuilding
Prima di usare qualsiasi sostanza (farmaco o semplice integratore da banco) è d’obbligo possedere una conoscenza di base di come un integratore, un ormone o un farmaco, agisce per costruire e/o conservare la massa muscolare. Conoscere come un ormone agisce nel corpo è necessario per prendere decisioni e gestire i propri regimi di utilizzo. Senza questa conoscenza finirete senza dubbio con lo sprecare molti soldi e, cosa molto più importante, forse mettere a rischio la salute.
Il GH (Growth Hormone), noto anche come somatotropina (STH), ormone somatotropo, ormone della crescita, è un ormone peptidico secreto dall’adenoipofisi composto da 191 amminoacidi per un peso di 22.005 Da. La sua funzione principale è di stimolare lo sviluppo dell’organismo umano, promuovendo l’accrescimento e la divisione mitotica delle cellule di quasi tutti i tessuti corporei.
Da tempo si pensa che il GH eserciti i suoi effetti anabolici sui tessuti periferici attraverso gli IGF, detti anche somatomedine (“mediatori della crescita”). Le proteine leganti ricoprono un ruolo importante nella moderazione degli effetti anabolici sia del GH che dell’IGF-1. L’IGF-1 è controllato da almeno 6 proteine leganti diverse e forse ce ne sono altre da scoprire. A oggi esistono un paio di teorie su come il GH causa la crescita nei tessuti. La prima teoria si chiama ipotesi della somatomedina (Daughaday, 1972):
- L’ipotesi della somatomedina afferma che il GH è rilasciato dalla pituitaria e poi viaggia fino al fegato e altri tessuti periferici dove causa la sintesi e il rilascio degli IGF.
Gli IGF si chiamano così a causa della loro similitudine strutturale e funzionale con la proinsulina. Questa ipotesi dice che gli IGF funzionano come fattori di crescita endocrini, ciò significa che dopo il rilascio da parte dei tessuti che li producono, in particolare il fegato in questo caso, viaggiano nel sangue fino ai tessuti di destinazione. Sono seguiti molti studi che mostrano che negli animali con carenza di GH le infusioni sistemiche di IGF-1 conducono alla crescita normale. Gli effetti erano simili a quelli osservati dopo la somministrazione di GH. Cosa interessante, sono seguiti altri studi che mostrano che l’IGF-1 è un fattore di crescita endocrino molto inferiore in quanto necessita di una quantità di quasi 50 volte superiore per esercitare gli stessi effetti del GH (Skottner, 1987). Recentemente l’rhIGF-1 è diventato molto più disponibile e al momento è approvato per la cura della sindrome degenerativa associata all’HIV. Questa maggiore disponibilità ha permesso la sperimentazione nell’uomo di questa ipotesi. Studi su soggetti affetti da insensibilità al GH (sindrome di Laron) hanno avvalorato costantemente l’ipotesi della somatomedina (Rank, 1995; Savage, 1993).
La seconda teoria su come il GH produce i suoi effetti anabolici si chiama teoria dell’effettore duplice (Green, 1985):
- Il GH produce da solo degli effetti anabolici sui tessuti del corpo senza bisogno dell’IGF-1.
Questa teoria è stata supportata da studi che hanno iniettato il GH direttamente nelle placche di crescita. Ulteriori prove a supporto di questa teoria sono presenti in ceppi di cavie geneticamente modificate. Quando si confrontano le cavie con valori geneticamente alti di GH e le cavie con valori geneticamente alti di IGF-1, quelle con valori alti di GH sono più grandi. Qualcuno ha utilizzato questa prova a sostegno della teoria dell’effettore duplice. Cosa interessante, quando l’IGF-1 antisiero (distrugge l’IGF-1) è somministrato insieme al GH, tutti gli effetti anabolici del GH sono annullati.
La teoria della somatomedina e la teoria dell’effettore duplice non sono molto diverse. Una afferma semplicemente che il GH può produrre crescita senza IGF-1. In base alle ricerche sono incline a credere alla teoria della somatomedina. La questione assume importanza solo quando si decide se usare o no solo il GH oppure di combinarlo con l’IGF-1 o l’insulina.
In base alle informazioni al momento disponibili si contano tre importanti meccanismi attraverso i quali il GH produce crescita (Spagnoli, 1996):
- Gli effetti del GH sulla formazione delle ossa e sulla crescita degli organi sono mediati dall’azione endocrina dell’IGF-1.
Come detto nell’ipotesi della somatomedina, il GH, rilasciato dalla pituitaria, causa una maggiore produzione e rilascio di IGF-1 nella circolazione generale. Poi l’IGF-1 viaggia fino ai tessuti di destinazione come le ossa, gli organi e i muscoli per causare gli effetti anabolici.
- Il GH regola l’attività dell’IGF-1 aumentando la produzione di proteine leganti (in particolare l’IGFBP 3 e altre proteine importanti dette subunità acido-labile) che aumentano l’emivita dell’IGF-1 da minuti a ore. Poi le proteasi circolanti agiscono per rompere il complesso proteina legante/ormone rilasciando così l’IGF-1 in modo controllato nel corso del tempo.
Il GH può anche far sì che i tessuti di destinazione producano IGFBP-3 aumentando la sua efficacia locale.
- Nei tessuti di destinazione l’IGF-1 non esercita soltanto azioni endocrine ma anche azioni paracrine/autocrine.
Questo significa che quando il GH arriva nei muscoli le cellule muscolari aumentano la loro produzione di IGF-1. Questo IGF-1 può poi spostarsi nelle cellule adiacenti (specialmente nelle cellule satellite) producendo crescita e una maggiore capacità rigenerativa delle cellule che non hanno visto il GH. Questo secondo la teoria dell’effettore duplice.
E’ interessante notare che i bambini producono “picchi” di 2UI di GH dalle quattro alle sette volte al giorno per quattro/cinque giorni non consecutivi durante un periodo di due/tre settimane (durante i picchi di crescita). Ciò equivale a 32-70UI in soli quattro/cinque giorni. L’Ipofisi di un adulto sano rilascia soltanto 0,5-1,5UI al giorno.
Fino alla metà degli anni ’80, l’unica forma disponibile di GH esogeno era prodotto prendendo l’Ipofisi dei cadaveri e macinandola. Il GH era poi estratto e purificato attraverso una serie di procedure costose, confezionato e venduto dietro ricetta solo per l’uso da parte dei bambini che soffrivano di problemi di crescita. Per questo ed altri motivi, il GH era off-limitz per la Old School di Arnold o di Zane. Nel 1987, questa forma di GH è stata collegata a una malattia cerebrale fatale detta Morbo Creutzfeld-Jacob ed è stata tolta dal mercato.
Arrivò poi la Genetech che lanciò il GH sintetico. Il primo GH sintetico è stato prodotto modificando geneticamente le cellule delle cavie trasformate. Il GH naturale, come ben sappiamo, ha una sequenza di 191 aminoacidi mentre il GH Protropin prodotto dalla Genetech ha 192 aminoacidi nella sua sequenza. Ciò può stimolare il corpo a produrre anticorpi per il GH che lo disattivano. Adesso la maggior parte dei prodotti sintetici contiene la normale sequenza di 191 aminoacidi. Oggi ne esistono in commercio una dozzina. Comunque, in alcuni soggetti il corpo produce anticorpi in seguito alla somministrazione di GH esogeno, vanificando il suo uso. Il GH, usato correttamente, è noto per essere un livellatore genetico, se usato per questo scopo.
Ovviamente, il lancio del GH sintetico permise agli atleti (in specie BodyBuilder) di poterlo inserire nelle loro preparazioni. Il motivo per cui gli atleti si sono avvicinati al GH esogeno (già accennato in precedenza) è semplice e riconducibile a tre effetti che qualsiasi atleta desidera:
- Il GH aiuta il corpo a bruciare più tessuto adiposo favorendo il rilascio di acidi grassi da usare come energia.
Solitamente, a riposo il corpo usa una pari quantità di grassi e calorie.
Quando il sistema endocrino percepisce un livello basso di glucosio circolante, l’assi ipotalamo-ipofisi (HPA) reagisce rilasciando GH. Il GH innesca (attraverso una serie di reazioni enzimatiche/chimiche) il rilascio di acidi grassi dalle riserve adipose per soddisfare i fabbisogni metabolici energetici. E’ stato ben documentato che anche la somministrazione di GH esogeno produce lo stesso effetto.
- Il GH esercita un effetto anabolizzante molto potente. Nell’esercizio dei suoi effetti anabolizzanti, può causare sia l’iperplasia muscolare (un incremento del numero delle cellule muscolari) sia l’ipertrofia muscolare (l’ingrossamento delle fibre muscolari).
Questa modifica nel numero delle cellule muscolari è permanente, perciò significa più cellule da far crescere. Il GH esercita anche un effetto anabolizzante sui tessuti molli come i tendini, le cartilagini e altri tessuti connettivi. Questo significa che grazie a un tessuto connettivo più forte i vecchi infortuni si risolvono e la forza aumenta, entrambe le cose ad un ritmo accelerato: sfortunatamente, questa azione anabolica conduce (dose/tempo dipendente) alla comparsa della neuropatia. E’ ben noto che il GH è un potente agente anti catabolico (salvaguardia delle proteine). Questo ha permesso (tra le altre cose) ai BodyBuilder moderni di conservare o addirittura aumentare la massa muscolare durante i periodi con calorie ridotte (fasi di definizione/Pre-gara).
- Il GH converte a livello epatico in IGF-1.
Il corpo ha una capacità limitata di conversione del GH in eccesso in IGF-1 se non ci sono anche livelli elevati di altri ormoni. L’Insulina, gli ormoni tiroidei (T4/T3), le Gonadotropine, gli AAS e anche gli Estrogeni e i Corticosteroidi, ricoprono tutti un ruolo importante negli effetti positivi del GH. Così, anch’essi sono stati aggiunti esogenamente da alcuni atleti allo scopo di raggiungere i “rapporti corretti” ormonali. Per far si che il fegato converta gli alti livelli di GH in IGF-1 più volte al giorno causando una risposta anabolizzante di alto livello, spesso è stato detto che anche gli ormoni tiroidei e l’Insulina dovevano aumentare. Il T3 sintetico è stato considerato una scelta migliore anche perché il GH sopprime il rilascio di ormone T3 naturale. L’uso di Insulina* rapida (Humulin-R) ha permesso agli atleti di sincronizzare l’attività dell’Insulina esogena con il periodo attivo del GH nei momenti di assorbimento ottimale come ad esempio appena alzati e nelle prime ore successive all’allenamento. Il risultato è stato un minore accumulo di grasso e una maggiore risposta anabolizzante.
(*L’uso dell’Insulina è molto pericoloso. Se usata nel modo sbagliato può condurre al coma e alla morte. Se volete usarla, fatevi tenere sotto stretto controllo da un medico o Preparatore con adeguate competenze mediche.)
Dosaggio e somministrazione del GH
La questione della dose di GH “ideale” è complessa. Per curare i ritardi della crescita, le case farmaceutiche produttrici di GH consigliano 0,3UI la settimana ogni 0,5Kg di peso corporeo.
Quindi, per un BodyBuilder di 106Kg ci vorrebbero 64UI la settimana, pari a una dose giornaliera di circa 10UI. Comunque, anche 2-3UI il giorno hanno prodotto buoni risultati in un periodo di tempo di 6-8 settimane quando sono stati soddisfatti anche gli altri fabbisogni ormonali. Anche cicli brevi con dosi alte hanno creato ottimi effetti negli atleti che sapevano gestire il tutto in modo “intelligente”. Uno dei lati positivi dei cicli brevi e intensi di GH è l’assenza di incrementi significativi di Somatostatina: comunque, la Somatostatina è facilmente riducibile con l’uso di L-Arginina e dei suoi analoghi. Il range dei dosaggi di GH usati mediamente dagli atleti si aggirano dalle 2UI fino alle 16UI al giorno (1mg= 2,7UI di GH).
I metodi di somministrazione del GH sono due: iniezioni sottocutanee o intramuscolari. La maggior parte degli atleti opta per le iniezioni sottocutanee. Se guardate le informazioni cliniche fornite dai vari produttori di GH o dai vari studi reperibili in rete, vedrete che la biodisponibilità di GH somministrato con iniezioni sottocutanee o intramuscolari è molto vicina, come lo sono le concentrazioni medie plasmatiche dopo la somministrazione. Anche se, nel caso delle iniezioni sottocutanee è di circa il 10% in più a causa dell’assorbimento leggermente più rapido del GH rispetto a quando viene iniettato intramuscolare (l’emivita è di circa 3-4 ore iniettato sottocute e di circa 4-5 ore iniettato intramuscolo). Tuttavia, poiché il tasso di assorbimento è leggermente più rapido ed i livelli plasmatici sono leggermente superiori quando iniettato sottocute, ciò non si tradurrà necessariamente in maggiori livelli di IGF-1; non vi è alcuna differenza farmacologica significativa tra i due metodi. C’è da dire però che, in caso di iniezioni multiple molti atleti e preparatori hanno notato risultati migliori con la somministrazione sottocutanea.
Quando il GH è utilizzato in un protocollo che comprende l’uso di Insulina, è importante distanziare le iniezioni di GH e quelle di Insulina di circa un ora. Inoltre, se il GH viene somministrato solo due volte al giorno, è saggio evitare la somministrazione nei momenti di grande rilascio naturale di GH come la mattina presto, dopo l’allenamento e appena prima di andare a letto. Questo se il GH era utilizzato senza Insulina.
E’ giusto ricordare che, il GH incrementa la crescita delle fibre di tipo-I più di quelle di tipo-II. La co somministrazione di androgeni forti (ad esempio Trenbolone) permette la “conversione” delle fibre di tipo-I in fibre di tipo-2 per la forza e la massa. Questo è un esempio di sinergia a lungo termine creata dall’uso di GH.
Alcuni punti interessanti sulla sinergia GH/Insulina:
- l’Insulina favorisce l’assorbimento cellulare di circa la metà degli aminoacidi per la riparazione e la crescita, mentre il GH favorisce l’assorbimento dell’altra metà.
- l’Insulina incrementa la conversione del T-4 in T-3, mentre il GH ne riduce la conversione epatica.
- l’Insulina è ipoglicemica – il GH è iperglicemico.
- l’Insulina deposita i grassi – il GH rilascia i grassi.
Usare GH senza AAS o Insulina è anticatabolico ma non anabolico. L’uso del solo GH non permette l’incremento significativo delle proteine contrattili delle fibre muscolari. Questo proprio perché al GH manca la capacità di indurre l’assorbimento di tutti gli aminoacidi essenziali e perciò la gran parte della crescita si verifica nelle proteine strutturali.
Come prima accennato, dal momento che il GH riduce i livelli di T-3, riducendo ulteriormente la sintesi proteica, la mancata somministrazione di triiodotironnina si rivela una cattiva scelta.
Come è ben noto a quasi tutti, per il mondo girano enormi quantità di AAS e farmaci contraffatti.
La cosa, ovviamente, interessa anche il GH sintetico. Quando acquistato al mercato nero, per verificare se il GH è vero, molti hanno semplicemente acquistato un test di gravidanza. Dopo aver miscelato una vial di (presunto) GH si mette una goccia o due nel punto di esame. Se il risultato è “positivo” vi trovate davanti a della semplice Gonadotropina (HCG).
Quando potete (soldi permettendo) assicuratevi di acquistare GH di farmacia come il Saizen o il Genotropin. Se non riuscite a procurarvi GH farmaceutico, potete “ripiegare” sull’Hygetropin assicurandovi ovviamente della sua validità.
Gli effetti collaterali riscontrabili con l’uso di GH sono i seguenti:
- Ingrossamento dei Reni
- Ingrossamento del Cuore
- Pressione ematica alta
- Diabete
- Ipotiroidismo
- Acromegalia
- Neuropatia
Si tratta di effetti collaterali rari (eccezion fatta per la Neuropatia) e solitamente dovuti a dosi
estremamente alte e cicli molto lunghi. Purtroppo, i problemi emergono quando diventano rilevanti.
hGH Fragment 176-191
Esiste una variante del GH chiamata hGH Fragment 176-191. Gli scienziati hanno scoperto che se viene troncato il legame originario del peptide nella regione terminale C si isolano i potenziali sulla perdita di grasso associati con il classico GH. Si è così scoperto che il peptide ottenuto ha una capacità di aumentare la perdita di grasso 12,5 volte meglio del classico GH. hGH Fragment 171-191 è quindi utilizzato da quei BodyBuilder che non cercano le proprietà anabolizzanti del GH ma le sue sorprendenti proprietà sulla perdita di grasso.
Come già accennato, hGH Fragment 176-191 ha una incredibile capacità di regolare il metabolismo dei grassi, con l’aggiunta di non apportare gli effetti collaterali negativi sulla sensibilità all’insulina.
In realtà, inibisce anche la lipogenesi; e ciò significa che ha la capacità di arrestare la sintesi di acidi grassi e di altri lipidi. Dal momento che non è in concorrenza per i recettori del GH, diversi studi hanno dimostrato che l’hGH Fragment 176-191 non causa iperglicemia.
Al fine di ottenere dei benefici dall’uso di hGH Fragment, gli utilizzatori assumono dosaggi intorno ai 500mcg al giorno. Questo può essere fatto dosando 250mcg al mattino pre-allenamento e 250mcg prima di pranzo o 250mcg prima di dormire. Gli utilizzatori devono tenere conto dei tempi di iniezione e dei loro pasti. E ‘ottimale iniettare hGH Fragment 176-191 a stomaco vuoto o con un pasto esclusivamente proteico. Come per altri peptidi, hGH Fragment non risulta efficace quando somministrato in concomitanza con pasti contenenti carboidrati e zuccheri. Solitamente l’hGH Fragment viene somministrato insieme a secretagoghi del GH come il GHRH-6. Utilizzando l’hGH Fragment non si verificano i problemi agli ormoni tiroidei, alla sensibilità al glucosio, formicolio, o i problemi di sindrome del tunnel carpale. Gli effetti collaterali più comunemente associati con hGH Fragment 176-191 sono pochi ma possono includere: arrossamento o dolore al sito di iniezione, e eccessiva sonnolenza o letargia.
Di recente stanno spopolando nel mondo del BodyBuilding dilettantistico diversi peptidi con capacità secretagoga del GH (leggi anche Ibutamoren). Ne esistono di diversi tipi e con effetti avversi differenti; tra i più utilizzati troviamo il GHRP-2, il GHRP-6, l’Ipamorelin e il CJC 1295. Personalmente, considero questi peptidi una buona scelta solo per chi non può permettersi il GH o per i novizi.
IGF-1: funzioni, varianti e applicazioni nel Bodybuilding
I fattori di crescita insulino-simili, noti anche come IGF (sigla di Insulin-like Growth Factor) o somatomedine, sono un gruppo di ormoni peptidici dalle proprietà anaboliche, prodotti dal fegato sotto lo stimolo dell’ormone della crescita (GH) prodotto dall’ipofisi. Ne esistono due isoforme:
- IGF-1 (somatomedina C o SM-C): è massimo in pubertà e diminuisce con la vecchiaia. Esso è strettamente GH dipendente.
- IGF-2 (somatomedina A o SM-A): è presente soprattutto nella vita fetale, ed è solo parzialmente GH dipendente.
In questa sede ci concentreremo, come ovvio, sull’IGF-1.
Per capire come funziona l’IGF-1 bisogna capire come crescono i muscoli. La capacità del tessuto muscolare di rigenerarsi costantemente in risposta all’attività fisica lo rende unico. La sua capacità di rispondere allo stimolo fisico/meccanico dipende in gran parte da quelle che si chiamano cellule satellite. Le cellule satellite sono cellule precursori dei muscoli. Le si possono considerare delle cellule “promuscolo”. Sono cellule che si trovano sopra e intorno alle cellule muscolari. Queste cellule restano dormienti fino a quando vengono chiamate in causa dai fattori di crescita come l’IGF-1. Dopo di ciò queste cellule si dividono e si trasformano geneticamente in cellule che hanno un nucleo identico a quello delle cellule muscolari. Queste nuove cellule satellite con nucleo muscolare sono fondamentali, se non necessarie, per la crescita muscolare.
Senza la capacità di aumentare il numero dei nuclei una cellula muscolare non crescerà e la sua capacità di ripararsi sarà limitata. La spiegazione di ciò è piuttosto semplice. Il nucleo della cellula è il posto da dove originano tutti i progetti di nuova crescita. Più il muscolo è grande, più sono i nuclei necessari per mantenerlo. Esiste infatti un rapporto “nuclei-volume” da cui non si può esulare. Ogniqualvolta un muscolo cresce in risposta al sovraccarico funzionale si verifica una correlazione positiva fra l’aumento del numero dei mionuclei e l’aumento dell’area di sezione della fibra (CSA). Quando alle cellule satellite è impedito di donare nuovi nuclei, il muscolo sovraccaricato non cresce (Rosenblatt, 1992 & 1994; Phelan, 1997). Vedete, un fattore importante per la crescita muscolare non naturale è l’attivazione delle cellule satellite da parte dei fattori di crescita come l’IGF-1.
L’IGF-1 stimola sia la proliferazione (incremento del numero delle cellule) che la differenziazione (conversione in nuclei muscolari specifici) in modo autocrino/paracrino, anche se soprattutto stimola la differenziazione. Anche la teoria dell’effettore duplice lo conferma. Infatti, si può iniettare l’IGF-1 in un muscolo e vederlo crescere! Gli studi hanno mostrato che, quando iniettato localmente, l’IGF-1 aumenta l’attività delle cellule satellite, il contenuto di DNA del muscolo, il contenuto proteico del muscolo, il peso muscolare e l’area della sezione muscolare trasversale (Adams, 1998).
I ricercatori stanno adesso scoprendo il percorso di segnalazione attraverso il quale la stimolazione meccanica e l’attività dell’IGF-1 producono tutti i sopraddetti cambiamenti nelle cellule satellite, nel contenuto di DNA del muscolo, nel contenuto proteico del muscolo, nel peso muscolare e nell’area della sezione muscolare trasversale. Questa ricerca origina da studi fatti per spiegare l’ipertrofia cardiaca. Ciò coinvolge un enzima muscolare detto calcineurina che è un enzima fosfatasi attivato da alte concentrazioni intracellulari di ione calcio (Dunn, 1999). Notare che il muscolo sovraccaricato è caratterizzato da concentrazioni intracellulari cronicamente alte di ione calcio. Altre ricerche recenti hanno dimostrato che l’IGF-1 aumenta le concentrazioni intracellulari di ione calcio conducendo all’attivazione del percorso di segnalazione e alla susseguente ipertrofia delle fibre muscolari (Semsarian, 1999; Musaro, 1999).
Riassumendo, i ricercatori coinvolti in questi studi hanno dato questa spiegazione:
l’IGF-1, oltre ad attivare la calcineurina, induce l’espressione del fattore di trascrizione GATA-2 che si accumula in un sottoinsieme di nuclei muscolari dove si associa con la calcineurina e una forma specifica defosforilizzata del fattore di trascrizione fattore nucleare delle cellule attivate T o NF-ATc1.
Perciò, l’IGF-1 induce la segnalazione e l’attivazione del GATA-2 mediate dalla calcineurina, un segno dell’ipertrofia dei muscoli scheletrici che coopera con isoformi NF-ATc specifici per attivare i programmi di espressione genetica che conducono a una maggiore sintesi delle proteine contrattili e all’ipertrofia muscolare.
Un effetto collaterale dell’assunzione di AAS metilati in C-17 è anche quello di aumentare la produzione naturale di IGF-1 da parte del fegato. Dato che i recettori dell’IGF-1 sono presenti sui muscoli e sugli organi come cuore, milza, intestino tenue e reni, maggiore è la concentrazione di recettori, maggiore è l’effetto esercitato sugli organi.
L’IGF-1 ricombinante (geneticamente modificato) è efficace quando iniettato intramuscolo perché causa una crescita localizzata. E’ il metodo più usato. Il farmaco ha una emivita di circa 10 minuti e se è, o è stato, legato all’IGF-BP3 (Proteina Legante l’IGF-1) l’emivita è estesa fino a 12 ore circa.
Spesso si associa l’Insulina e/o il GH con l’IGF-1 perché quest’ultimo blocca la produzione di GH naturale e il GH causa resistenza all’Insulina. Spesso l’IGF-1 è considerato un pro-Insulina perché combatte la resistenza all’Insulina e interagisce con l’Insulina. Si tratta comunque di una definizione imprecisa.
L’IGF-1 può avere tutti gli effetti collaterali dell’uso di GH o di Insulina con uno svantaggio aggiunto: crescita gastrointestinale. Questo succede perché nel tratto gastrointestinale si trovano molti più recettori dell’IGF-1 di quanti se ne trovino nei muscoli scheletrici. Questi ultimi hanno più recettori per il GH. Ciò spiega gran parte del gonfiore visto più volte nelle competizioni di BodyBuilding d’alto livello. L’IGF-1 è stato usato clinicamente nei bambini con dosi di oltre 3-7mg al giorno. Cioè 3000-7000mcg al giorno! Non si sono verificati effetti collaterali negativi e non se ne attendevano. Nel BodyBuilding le dosi medie sono nettamente inferiori e vanno da 60 a 1000mcg al giorno divisi in iniezioni intramuscolari eseguite sui muscoli allenati. E’ inutile sottolineare che con l’uso di IGF-1 si è sperimentata una crescita localizzata molto marcata. E’ importante notare che l’IGF-1 può causare ipoglicemia ed è quindi fondamentale l’uso di un kit per la misurazione della glicemia.
Varianti IGF-1: Des (1-3) e LR3
Quando un chimico elimina gli ultimi tre aminoacidi della catena (il tripeptide N-terminale), l’IGF-1 diventa Des (1-3) che è del 1000% più anabolizzante. Il perché è molto semplice: la maggior parte dell’IGF-1 circolante è inattivo perché è legato a un’altra proteina detta proteina legante l’IGF-1 3, ovvero IGF-1-BP3. Dal momento che gli ormoni legati non possono entrare nel loro sito recettore per stimolarlo, l’IGF-1 circolante e muscolare non può produrre uno stimolo anabolico. Ma quando l’IGF-1 viene modificato e reso Des (1-3), la proteina legante IGF-1-BP3 non può legarcisi ed è totalmente attivo.
Un’altra ragione per cui il Des (1-3) è la sua capacità unica di legarsi ai siti recettori dell’IGF-1 modificati dall’Acido Lattico: quando ci alleniamo usiamo substrati energetici come i carboidrati per produrre ATP cellulare. Quando le cellule passano a questo percorso dell’ATP, il sottoprodotto è l’acido lattico. Questa, ovviamente, è la causa principale del bruciore che si avverte durante l’esecuzione di serie intense o con un alto numero di ripetizioni. Dunque, l’accumulo di acido lattico si chiama acidosi e distrugge la forma di alcuni siti recettori per un po’ di tempo.
Perciò, alcuni ormoni anabolici/anticatabolici hanno difficoltà (anche l’IGF-1 non legato) a unirsi con il loro rispettivo sito recettore e stimolare una risposta. Questo non succede al Des (1-3) che si unisce al sito recettore dell’IGF-1 anche dopo l’acidosi. Il Des (1-3) non è legato, ad è oltre 10 volte più potente dell’IGF-1 e libera gli ingressi del sito recettori. Purtroppo, ha una vita attiva di soli pochi minuti.
E’ interessante notare che il corpo è in grado di produrre Des (1-3). Quando un atleta si allena, l’acido lattico si accumula nel tessuto muscolare. Come sappiamo, c’è sempre un residuo di GH/IGF-1 presente nel sangue e nei tessuti (compreso il muscolo) dagli allenamenti precedenti e altri fattori metabolici. Il bruciore dell’acido lattico stimola la produzione di IGF-1/GH dall’allenamento attuale e dai precedenti. Sfortunatamente , l’acido lattico distrugge parte dell’IGF-1 presente nei muscoli allenati. Ma questo risulta positivo.
L’acido lattico taglia (tronca) gli ultimi 3 aminoacidi della catena di 70 amminoacidi di “parte” dell’IGF-1 sopravvissuto e crea Des (1-3). Quindi, l’acidosi aumenta la produzione epatica di GH/IGF-1, slega l’IGF-1 localmente nel muscolo allenato (bruciato), distrugge parte dell’IGF-1 e ne converte un’altra parte in Des (1-3). La versione sintetica sta cominciando da diversi anni ad essere sempre più frequente nel mercato nero.
Le dosi mediamente usate di Des (1-3) vanno dai 50 ai 150mcg più volte al giorno (dopo l’allenamento) in iniezioni localizzate nei muscoli allenati. Dal momento che Des (1-3) ha una breve emivita (20-30 minuti), la desensibilizzazione recettoriale non è stata rilevata.
Esiste un’altra forma di IGF-1 simile al prima citato Des (1-3): l’LR3. Al pari del Des (1-3), l’LR3 è modificato chimicamente così che non presenti legame con le proteine di trasporto IGF-1-BP3. Ma c’è di più: mentre il Des (1-3) presenta una vita attiva di soli pochi minuti, l’LR3 presenta una emivita di 20 30 ore! In poche parole, l’LR3 è la versione a lunga durata del classico IGF-1. Comunque, risulta meno potente rispetto al Des (1-3). Grazie alla sua lunga emivita, l’LR3 è spesso iniettato in un sito “a-specifico” grazie al fatto che la crescita risulta potenziata nel complesso e non localmente. LR3 ha la capacità di impedire al glucosio di entrare nelle cellule e ciò, a sua volta, si traduce in una costrizione metabolica per cui il corpo brucia i grassi e non il glucosio. I dosaggi mediamente utilizzati per l’LR3 si aggirano intorno ai 50-150mcg al giorno tutti i giorni per un periodo massimo di 40 giorni (o meglio 4 settimane) dato che la desensibilizzazione recettoriale si verifica all’incirca in questo arco di tempo.
E’ importante capire che gli effetti collaterali negativi a lungo termine non sono stati ancora ben analizzati. Qualsiasi cosa possieda il potenziale di modificare la genetica ha anche un uguale potenziale negativo.
Androgeni Anabolizzanti e aumento dei livelli di GH e IGF-1
A questo punto vorrei approfondire una questione, e cioè lo stimolo del GH e dell’IGF-1 tramite l’uso di AAS. Anche se questo non è esattamente un articolo sugli androgeni di per sé, gli androgeni ricoprono un ruolo importante nella modulazione del GH quando si cerca di aumentare la massa muscolare. Per capire questa relazione dobbiamo ritornare agli anni difficili della pubertà.
Durante la pubertà si verifica un inceppamento nella capacità del corpo di regolare con precisione i livelli di GH creando maggiori livelli di GH, IGF-1 e insulina. Ciò si combina con la forte produzione di testosterone che caratterizza la pubertà. La ricerca ha mostrato che questo inceppamento è causato dall’aromatizzazione del testosterone e da alcune azioni dirette degli androgeni. In uno studio recente svolto da Friburg sono stati confrontati gli effetti del testosterone e dello stanozololo sulla stimolazione del rilascio del GH. Il testosterone enantato (solo 3 mg/kg alla settimana) aumentava i livelli di GH del 22% e i livelli di IGF-1 del 21% laddove lo stanozololo orale (0,1 mg/kg alla settimana) non ha avuto nessun effetto sui livelli di GH o di IGF-1. Un paio di osservazioni su questo studio. È durato solo 2-3 settimane e anche se lo stanozololo non ha influenzato i livelli di GH o di IGF-1, ha prodotto degli effetti simili sui livelli di azoto nell’urina. L’azoto nell’urina è denso di variabili disorientanti quando usato per determinare l’anabolismo e/o il catabolismo dei muscoli scheletrici e perciò non andrebbe considerato un indice accurato della crescita dei muscoli scheletrici. Usare gli amminoacidi traccianti marcati o la 3-metilistidina è un modo di gran lunga più preciso per determinare l’effettiva sintesi e disgregazione delle proteine contrattili. Comunque, questo studio può spiegare in parte l’osservazione che molti bodybuilders non rispondono ai prodotti a base di testosterone con il blocco completo degli estrogeni. E’ anche vero che l’uso di AAS orali metilati in C-17, ha causa proprio dello stress epatico indotto dalla metilazione, aumentano la produzione di IGF-1 epatica. Solitamente i dosaggi necessari per far si che avvenga un aumento significativo della produzione epatica di IGF-1 sono superiori agli 0,1mg/Kg di peso dello studio preso in esame precedentemente citato.
Troppo Cytadren e soprattutto Arimidex prevengono la ginecomastia e un eccesso di ritenzione idrica ma riducono anche i guadagni muscolari attraverso un aumento del GH meno forte e susseguenti livelli di IGF-1 più bassi. In vitro è stato anche visto che alcuni androgeni aumentano la sensibilità delle cellule muscolari satellite al fattore di crescita fibroblastico e all’IGF-1.
Ricordatevi che le cellule satellite sono necessarie per la crescita della cellula. Le cellule muscolari satellite dei bovini riuscivano a fondersi del 20% più velocemente quando trattate con il trenbolone e l’estradiolo . Qualcuno può pensare che non sia stato solo il trenbolone ma anche l’estradiolo a causare l’aumento significativo dell’efficacia dell’alimentazione e della crescita muscolare attraverso l’aumento della produzione di GH e di IGF-1 sia nel fegato che nelle cellule muscolari. Da questi studi appare chiaro che l’IGF-1 è fondamentale per trarre l’attività anabolica massima dagli androgeni. Questo significa che molto probabilmente gli androgeni che aumentano la produzione di GH (cioè quelli che aromatizzano) produrranno i guadagni di massa muscolare più consistenti e rapidi.
E’ anche vero che l’uso di AAS orali metilati in C-17, ha causa proprio dello stress epatico indotto dalla metilazione, aumentano la produzione di IGF-1 epatica. Ovviamente, solitamente i dosaggi necessari per far si che avvenga un aumento significativo della produzione epatica di IGF-1 sono superiori agli 0,1mg per Kg di peso dello studio preso in esame.
Insulina: funzioni, varianti e applicazioni nel Bodybuilding
L’Insulina è un ormone peptidico dalle proprietà anaboliche non specifiche, prodotto dalle cellule β delle isole di Langerhans all’interno del pancreas; è formata da due catene unite da due ponti solfuro: catena A di 21 aminoacidi e catena B di 30 aminoacidi. La sua funzione più nota è quella di regolatore dei livelli di glucosio ematico riducendo la glicemia mediante l’attivazione di diversi processi metabolici e cellulari. Ha inoltre un essenziale ruolo nella proteosintesi (sintesi proteica) assieme ai prima citati ormoni che sinergicamente partecipano a tale processo: l’asse GH/IGF-1, e il Testosterone.
L’insulina stimola l’ingresso di glucosio nel citosol delle cellule di organi insulino-dipendenti legandosi ad un recettore esterno della membrana cellulare. Tale funzione è possibile grazie all’interazione dell’insulina col suo recettore presente sulla membrana cellulare, che promuove la fosforilazione su tre residui di tirosina del peptide IRS-1 situato nel citoplasma. Il peptide così fosforilato agevola la fosforilazione del glicerofosfolipide fosfatidilinositolo-4,5-bifosfato (PIP2), ad opera dell’enzima fosfatidilinositolo-3-chinasi (PI3K), in fosfatidilinositolo-3,4,5-trifosfato (PIP3), che attiva a sua volta la proteina insulino-sensibile PKB. Tale proteina rende inattivo l’enzima glicogeno-sintasi-chinasi, responsabile dell’inattività della glicogeno-sintasi. Tale enzima, stimolato così dall’insulina, agevola la formazione e l’allungamento delle molecole di glicogeno nel fegato e nei muscoli scheletrici attraverso l’unione di monomeri di glucosio. Di pari passo disincentiva il processo di demolizione del glicogeno da parte della glicogeno fosforilasi, privandola di un gruppo fosfato tramite un enzima fosfatasi.
La carenza di insulina, o la resistenza cellulare a questa, determina una carenza di glucosio-6-fosfato, necessario al processo intracellulare di glicolisi che sintetizza piruvato a partire dal glucosio. L’ossalacetato, insieme all’acetil-CoA, costituisce la base del ciclo di Krebs. L’eccesso di acetil-CoA, non più utilizzabile per la condensazione del citrato, è destinato alla via chetogenica per produrre energia liberando CoA-SH e corpi chetonici, responsabili della chetoacidosi diabetica.
I suoi ormoni antagonisti sono il cortisolo (ormone alla base dell’insulinoresistenza), l’adrenalina, il glucagone, l’aldosterone e il GH. Gli ormoni che invece migliorano la sua azione sono il testosterone, il fattore di crescita insulino simile e, in minor misura gli estrogeni (stimolano la sintesi della proteina, la transcortina, che lega e inibisce il cortisolo).
Queste due catene derivano da un unico polipeptide da cui viene escisso il Peptide C, corto frammento proteico, apparentemente privo di funzioni fisiologiche che, in quanto secreto insieme all’insulina, è un utile indicatore della funzionalità insulare.
L’insulina ha anche altre funzioni non meno importanti, infatti stimola le mitosi, la crescita della massa muscolare ed ossea; contrariamente ad altri ormoni anabolizzanti, stimola anche la crescita della massa adiposa; aumenta il colesterolo LDL.
Nel sistema nervoso centrale, soprattutto nei neuroni che costituiscono il centro ipotalamico per la sazietà, troviamo i recettori per l’insulina. Nell’encefalo, infatti, quest’ormone non regola il metabolismo del glucosio, ma regola l’assunzione di cibo in quanto attenua la sensazione di fame.
Di conseguenza, quando una persona ha un basso livello di insulina (ad esempio in un diabetico), tende a mangiare più del dovuto, in quanto l’insufficiente azione dell’insulina non gli fa percepire la sazietà, con maggiore facilità a diventare obesa.
Normalmente, quando si citano le proprietà dell’ormone insulina, viene trattata principalmente la funzione di abbassare i livelli ematici di zuccheri nel sangue (glucosio), trasportandoli verso determinati tessuti che fungono da siti di stoccaggio o di riserva (tessuti insulino-dipendenti), ovvero il tessuto muscolare scheletrico, il cuore, e il tessuto adiposo, e altri tessuti verso cui essa ha un’azione indiretta sulla captazione di glucosio. In realtà l’insulina interviene in ogni caso con il semplice scopo di “nutrire” questi tessuti, anche in seguito all’introduzione di altri nutrienti, quali proteine (o aminoacidi e peptidi) e lipidi, e non solo con il compito di gestire un eventuale eccesso di zuccheri nel sangue.
L’insulina ricopre un ruolo sulla sintesi proteica in sinergia con gli ormoni GH (o somatotropina), IGF-1 (o somatomedina c) e il testosterone. In seguito all’introduzione di proteine, gli amminoacidi che ne derivano sono in parte utilizzati per la sintesi proteica e in generale per l’accrescimento.
Molti degli amminoacidi possono stimolare l’insulina, ma il loro potere insulinogenico varia in base al tipo, ai livelli di glucosio, e alla mescolanza con esso (vedere amminoacidi insulinogenici).
Amminoacidi misti e un pasto puramente proteico causano la produzione di insulina, ma meno rispetto ad un pasto puramente glucidico. La secrezione di tale ormone in seguito a un pasto proteico promuove l’uptake e lo stoccaggio di amminoacidi sotto forma di proteine muscolari e contrasta la proteolisi (il catabolismo proteico), un processo che promuove l’utilizzo di amminoacidi a scopo energetico per gluconeogenesi, principalmente durante il digiuno.
Alcuni ricercatori affermano che il ruolo principale dell’insulina sia quello di ridurre il catabolismo proteico ricoprendo in realtà un ruolo minore nella sintesi proteica, anche se alcuni studi hanno evidenziato il contrario. Altre evidenze suggeriscono che incrementare l’insulina senza incrementare contemporaneamente la disponibilità di amminoacidi tende a ridurre la sintesi proteica a causa di una riduzione delle concentrazioni di amminoacidi ematici. Invece gli amminoacidi derivanti dalle proteine alimentari sembrano esercitare il loro effetto principale nell’incremento della sintesi proteica, con minimi effetti sul catabolismo proteico, anche se non tutti gli studi hanno confermato questo effetto.
Le proteine stimolano sia la secrezione di GH che di insulina. Entrambi a loro volta favoriscono la
produzione di IGF (Fattore di crescita insulino-simile); in particolare l’IGF-1 è, come abbiamo già
visto, tra le somatomedine, quello che provoca l’aumento della massa magra (sebbene le proprietà
anaboliche vengano attribuite al GH, è in realtà l’IGF-1 il responsabile di tale effetto, che tuttavia è
strettamente dipendente dal GH). Allo stesso tempo, il GH, il quale non è direttamente coinvolto
nell’anabolismo proteico, ma piuttosto nella capacità di incremento di IGF, assieme al glucagone
previene l’ipoglicemia (sono ormoni iperglicemizzanti) causata dall’insulina in assenza di
carboidrati, innescando la lipolisi. In seguito all’introduzione di sole proteine/amminoacidi, la
concentrazione plasmatica di glucosio non può essere mantenuta perché non vi è introduzione di
glucosio con il pasto stesso, quindi devono essere secreti ormoni iperglicemizzanti, in primis il
glucagone, per stabilizzare i livelli di glucosio nel sangue grazie alla glicogenolisi epatica e la
gluconeogenesi.
Dunque insulina e GH (così come il glucagone) non sono sempre antagonisti, ma hanno un’azione
sinergica di rilievo in seguito all’introduzione di sole proteine sulla proteosintesi e sul mantenimento
dell’omeostasi glicemica. Anzi, solo la loro secrezione contemporanea favorisce la crescita, poiché
ognuno di essi (in realtà l’IGF-1, solo mediato dal GH) svolge una specifica attività distinta da
quella dell’altro, stivando una diversa selezione di aminoacidi (già accennato in precedenza). Invece,
in assenza di introduzione proteica, l’azione del GH non può tradursi in anabolismo proteico, poiché
questa azione è svolta dall’insulina e IGF-1. Nei casi di digiuno, quando la secrezione di GH
avviene senza la sinergia di questi ultimi, esso svolge altri ruoli metabolici tra cui la lipolisi, ma non
la proliferazione dei tessuti, come abbiamo già spiegato.
È la somministrazione di carboidrati che determina un reale antagonismo tra GH (e glucagone) e
insulina. I carboidrati infatti stimolano fortemente l’insulina con lo scopo di controllare il livelli
glicemici e gestire un eventuale eccesso, mentre il GH e il glucagone vengono inibiti, poiché non
devono antagonizzare l’effetto ipoglicemizzante dell’insulina a causa dell’abbondanza di glucosio,
ma al contrario, l’effetto dell’insulina non contrastato, causa un facile accumulo dell’eccesso di
carboidrati sotto forma di glicogeno e trigliceridi. L’insulina quindi causa lipogenesi se in presenza
di glucidi, o glucidi mescolati ad altri nutrienti, mentre le sole proteine non la inducono
all’accumulo di grasso, ma anzi al dimagrimento.
Storia e uso clinico dell’insulina
Prima che l’Insulina fosse scoperta, il diabete era una malattia temuta che poteva portare alla morte.
I medici sapevano che il diabete veniva aggravato dagli zuccheri, per cui ai pazienti venivano fatte seguire diete rigorose. Questo metodo poteva garantire al paziente un aspettativa di vita di qualche anno in più, ma la dieta da sola non li salvava. I medici hanno iniziato a capire che il pancreas dei diabetici era danneggiato e mal funzionante e, nel 1869, il tedesco Paul Langerhans scoprì che all’interno del tessuto pancreatico, che produce succhi digestivi, erano presenti gruppi di produzione di insulina dette cellule β.
La storia dell’Insulina è legata allo scienziato Nicolae Constantin Paulescu, nato a Bucarest il 30 ottobre 1869 e morto nella stessa città il 17 luglio del 1931. Siamo nel 1921 e Paulescu, primo al mondo, è in grado di curare il diabete, tanto che l’anno successivo, per la precisione il 10 aprile del 1922, ottiene il brevetto per la scoperta della Pancreina. Nel febbraio del 1922, quindi oltre otto mesi dopo, due ricercatori dell’Università di Toronto, il dottor Frederick Grant Banting ed il biochimico John James Richard Macleod pubblicano sul Journal of Laboratory and Clinical Medicine un saggio sui risultati positivi, nella normalizzazione dei livelli glicemici, ottenuti su un cane diabetico con l’uso di un estratto pancreatico acqueo. Si apre una lunga discussione perché i due ricercatori sembrano aver semplicemente messo in pratica ciò che Paulescu ha scritto nei suoi lavori precedenti ed in particolare nel saggio del 22 giugno dell’anno precedente. I due studiosi, infatti, fanno espresso riferimento a quell’articolo scientifico e dichiarano solo di confermare i rivoluzionari risultati ottenuti da Paulescu. Nel 1923, il comitato per il Nobel di Stoccolma assegna il Premio per la Fisiologia e la Medicina a Banting e Macleod, ignorando del tutto il lavoro e le ricerche di Paulescu. Tutte le contestazioni e suoi nuovi lavori pubblicati sugli Archives Internationales de Physiologie sono inutili. Lo scienziato Ion Pavel, negli anni settanta, in pieno regime comunista romeno, rese pubblica una lettera del 15 ottobre 1969 ricevuta da Charles H.
Best, un collaboratore di Banting e Macleod, nella quale si ammette che i due vincitori del Nobel non avevano fatto altro che riprodurre in laboratorio le ricerche di Paulescu. Comunque sia, nel 1922 venne curato con successo il primo paziente diabetico; un ragazzo di 14 anni, il quale ricevette l’estratto chiamato ‘Insulina’ ricavato dal pancreas di una mucca.
Fino agli inizi degli anni ‘80, 20 milioni di diabetici in tutto il mondo potevano accedere solamente all’insulina animale, prodotta da organi (pancreas) bovini e suini. Questo processo, dispendioso e ingombrante, riusciva a ottenere un prodotto poco ideale per il paziente dato che a lungo termine l’insulina animale è tossica all’organismo umano per motivi immunologici, causando malattie a livello epatico e effetti collaterali quali cecità, in alcuni casi persino la morte.
Grazie all’avvento dell’era biotecnologica è possibile produrre l’insulina tramite modificazione enzimatica dell’insulina prodotta dal maiale o tramite tecnologia del DNA ricombinante in sistemi batterici evitando possibili contaminazioni.
L’Insulina si ottiene con la tecnologia del DNA ricombinante dal 1982, quando negli Stati Uniti fu messo a punto un sistema batterico in E. coli. L’insulina è collegata al primo brevetto e al primo farmaco biotecnologico, messo in commercio.
La strategia di clonazione prevede la produzione delle catena A e B separatamente. È stata sintetizzata l’informazione per la catena A, fondendo la sequenza nucleotidica con il gene lacZ nel plasmide pBR322, vettore di clonazione in E. coli. nel punto di fusione tra lacZ e l’informazione relativa alla catena A è stato inserito il codone codificante l’amminoacido metionina.
La catena B è, invece, stata sintetizzata in due tempi: prima è stata sintetizzata la porzione N-terminale con procedimento analogo a quello seguito per la catena A; poi è stata sintetizzata la porzione C terminale con lo stesso procedimento. In seguito all’espressione di tali geni in E. coli si sono isolati i frammenti codificanti la catena, sono stati fusi col gene lacZ inserendo nel punto di fusione l’amminoacido metionina.
L’utilizzo del sistema lacZ/beta-galattosidasi ha numerosi vantaggi:
- il sistema è inducibile
- le catene vengono sintetizzate in fusione con la beta-galattosidasi, che svolge un’azione protettiva nei confronti della demolizione proteolitica.
I due peptidi vengono trattati quindi con bromuro di cianogeno, un agente chimico capace di scindere i peptidi con taglio proteolitico in corrispondenza dell’amminoacido metionina. Non resta, quindi, che purificare i prodotti di sintesi e di mescolare le due catene, permettendo la formazione spontanea dei ponti disolfuro.
Inoltre, l’insulina in soluzione è in equilibrio tra forma dimera ed esamera. In presenza di zinco assume forma esamera, diventando un complesso cristallino od amorfo più stabile ma insolubile, quindi di più lento assorbimento. La forma cristallina viene assorbita più lentamente ed è nota come “insulina ultralenta” e la sua azione appare dopo circa 36 ore; la forma amorfa è nota come “insulina semilenta”, viene assorbita più rapidamente e la sua azione ha una durata di soli 12-16 ore; la forma rapida ha un’emivita di 4 ore.
Tuttavia, la sintesi mediante l’utilizzo di batteri è molto scomoda, per diversi motivi. Primo tra tutti la difficoltà di assemblaggio (con conseguente bassa resa) delle due catene, dato che questi microorganismi, essendo procarioti, non possiedono tutto il macchinario di modificazione e secrezione necessario per una proteina oltretutto tipicamente degli eucarioti superiori. E poi vi sono gli alti costi per la sua purificazione. Tutto ciò può essere aggirato utilizzando i lieviti come organismi bio-reattori: essendo eucarioti, quindi provvisti di reticolo endoplasmico e apparato del Golgi altamente sviluppati, non avranno problemi ad assemblare correttamente e a secernere la proteina d’interesse.
Uso dell’insulina nel bodybuilding
Da quello che è stato detto fino ad ora, si evince che l’Insulina è l’ormone più anabolizzante “non specifico” (dal momento che è anabolico sia per il tessuto muscolare che per quello adiposo). I top Bodybuilders cominciarono ad inserire l’Insulina nelle loro preparazioni a partire dagli anni ’90 insieme al GH . E se avete fatto attenzione a ciò che ho precedentemente riportato, l’utilizzo dell’Insulina da parte degli atleti lo si deve alla sua capacità di aumentare il deposito intra cellulare di nutrienti. Ciò significa quindi che i nutrienti come il glucosio, gli aminoacidi e integratori come la Creatina e la Glutammina sono spinti dentro alla cellula in quantità molto maggiori. Dato che l’Insulina non è sito-specifica e che le cellule sia muscolari sia adipose hanno siti recettori per l’Insulina, i nutrienti sono depositati in entrambi questi tipi di cellule e anche negli organi.
L’effettiva suddivisione nel deposito dei nutrienti dipende fortemente dalla sensibilità dei recettori.
Per questa ragione, i soggetti che hanno sviluppato insulino-resistenza (insensibilità recettoriale) hanno una tendenza a guadagnare una quantità significativa di tessuto adiposo durante la somministrazione di Insulina. Ricordiamoci anche che l’Insulina è sia anabolica che anti-catabolica.
Dato che l’Insulina agisce sinergicamente con altre sostanze chimiche anabolizzanti/androgene, ci sono molti metodi, associazioni e protocolli che diversi atleti utilizzano con efficacia. Ci sono anche protocolli di “sicurezza” minima (“sicurezza” è una parola grossa con l’Insulina) che i BodyBuilders più intelligenti e meglio seguiti usano:
- Una dose singola di 1UI ogni 7Kg di peso corporeo e non più di due volte al giorno iniettate sottocute (un BodyBuilder di 90Kg userebbe 13UI, 90/7 = 13).
- Un ciclo d’uso dovrebbe durare tra 15 e 28 giorni con un periodo di pausa di 4-8 settimana. I periodi più lunghi perdono d’efficacia (insulino-resistenza).
- Per ogni UI di Insulina iniettata bisognerebbe ingerire un minimo di 10gr di carboidrati (un margine troppo esiguo). Qualcuno dice che così le calorie aumentano troppo. Personalmente non sono d’accordo e rimarrei su un margine di 15gr di carboidrati per ogni UI di Insulina in base al tempo d’azione dell’Insulina usata (lenta o breve).
- I due momenti di maggiore efficacia in cui si utilizza l’Insulina sono durante i due periodi di sensibilità più alta (periodi in cui anche il Cortisolo è alto):
- Prima dose al mattino (appena svegli prima del pasto)
- Immediatamente dopo un allenamento intenso.
- Gli AAS aumentano la sensibilità all’Insulina. Ciò significa che spesso le dosi sono più
basse (meno Insulina esogena) quando è stata associata con gli AAS e con altre sostanze
anabolizzanti. - Non utilizzare mai protocolli di Insulina in cui l’emivita di quest’ultima si sovrappone. Con
l’uso dell’Humulin-R, che ha un’emivita di 4 ore, fra le iniezioni devono passare minimo 4
ore. - Non usare mai l’Insulina senza la guida e il controllo di un medico o preparatore altamente
qualificato. Acquistare e imparare a usare un Kit per la misurazione del glucosio ematico. - Humalog viene somministrata circa 15 minuti prima di un pasto adeguato.
- Regular Tip-R è stata somministrata 30 minuti prima di un pasto adeguato.

Migliorare la sensibilità all’insulina (integratori e farmaci)
L’insensibilità all’Insulina ovvero l’Insulino-resistenza è una situazione medica legata fondamentalmente al diabete tipo-2. Potrei parlare per pagine di questa condizione ma si tratta di una condizione in cui i recettori dell’Insulina delle cellule muscolari diventano resistenti all’Insulina circolante rilasciata in risposta all’ingestione dei nutrienti. Dato che il corpo deve eliminare dal sistema il glucosio ematico in eccesso, le ormai super-sensibili cellule grasse si ingozzano fino a gonfiarsi mentre le cellule muscolari mangiano appena. La situazione peggiora quando le cellule muscolari digiune e affamate continuano a sperimentare livelli bassi di glucosio e le riserve di glicogeno epatico sono esaurite. Primo, il rilascio di proteine muscolari (catabolismo) si traduce in gluconeogenesi a spese della massa muscolare duramente guadagnata. Secondo, il segnale del bisogno di alimentazione delle cellule muscolari segnala al cervello che è necessario più cibo. Terzo, le cellule grasse si ingozzano di nuovo e il ciclo dell’ingrassamento ricomincia di nuovo.
Molti substrati alimentari influenzano la sensibilità all’Insulina in senso positivo o negativo.
Ovviamente, l’obiettivo di tutti gli individui sani è diminuire la resistenza all’Insulina ma un atleta deve concentrarsi sull’aumentare in modo significativo la sensibilità all’Insulina delle cellule muscolari e sul diminuire la resistenza delle cellule grasse. Il risultato è molta più massa muscolare magra e una riduzione significativa del tessuto adiposo.
Benché siano molti i substrati integrativi (leggi anche Tiamina e integratori utili contro il diabete) che hanno un certo valore in questo campo, ce ne sono alcuni che la ricerca e l’esperienza hanno indicato come più efficaci:
L-Arginina: è sufficiente l’ingestione di 2-4 grammi di L-Arginina con una bevanda post-workout di proteine /carboidrati per aumentare i tassi di sintesi di glicogeno del 30-40% nei soggetti sani.
L’Arginina è anche il precursore della sintesi di Ossido Nitrico (NO). Il NO gioca un ruolo chiave in ogni via metabolica anabolizzante nel corpo umano. L’aggiunta di L-Arginine e di Cofattori della sintesi di NO2 (400mcg di acido folico, 400 mg di N-acetilcolina e 1000mg di fenilalanina) possono aumentare la vita attiva del NO da pochi minuti a circa 12 ore. Due volte al giorno è l’assunzione migliore.
L-Glutammina: è un amminoacido che può essere convertito in glucosio attraverso la gluconeogenesi e utilizzato per la sintesi di glicogeno. Esso agisce anche come un mediatore non insulino dipendente per attivare la sintesi cellulare del glicogeno e del glucosio / aminoacidi. Questo si aggiunge alla riduzione dell’Insulino-resistenza. Le dosi vanno dai 20 ai 120 grammi al giorno; 20 grammi funziona bene.
Taurina: la taurina è un amminoacido che fornisce di per se un trasportatore non insulino-dipendente per i nutrienti. Questo significa che la taurina può imitare l’insulina nei siti recettori delle cellule muscolari. Migliora l’insulino-resistenza e aiuta a mantenere il colesterolo solubile. 2-4gr al giorno ai pasti è un dosaggio efficace.
Cromo Picolinato: migliora la sensibilità del sito recettore dell’insulina e in certa misura l’affinità recettoriale dell’Insulina. 200-400mcg di Cromo Picolinato al giorno è una dose efficace.
Acido Corosolico: l’Acido Corosolico agisce similmente all’Insulina nell’innescare una risposta cellulare insulino-simile nelle cellule muscolari, ma non nelle cellule adipose. Riduce la glicemia di circa il 20% con un dosaggio di 620mcg. L’Acido Corosolico si trova in una concentrazione pari a 600-620mcg per 50mg di polvere di Glucosol.
Cannella: 1/8 di cucchiaino di cannella 8 volte al giorno con il cibo può aumentare la sensibilità all’insulina fino al 300%.
Infuso di Salvia: (60gr circa di salvia) alcune ricerche hanno dimostrato che è in grado di aumentare la sensibilità all’Insulina fino a 500% (10-20% è più probabile).
Omega-3 (EPA+DHA): aumentano la sensibilità all’insulina modulando la produzione cellulare delle Prostaglandine “buone” (PG). Dai 2,5 ai 6 grammi al giorno di EPA+DHA.
D-pinitolo: degli integratori al momento disponibili considerati aiutare la sensibilità dei siti recettori dell’insulina il D-pinitolo ha superato con successo l’esame dei bodybuilder del mondo reale. Sebbene sia stato detto che il prodotto imita l’effetto dell’insulina, il suo vero valore risiede nella sua interazione unica con i siti recettori dell’insulina traducendosi nella riduzione della quantità di insulina necessaria per stimolare l’assorbimento e la sintesi delle proteine e del glicogeno. Questo integratore è classificato come un inositolo fosfoglicano. L’equivalente farmaceutico del D-pinitolo si chiama D chiroinositolo. In molti studi il D-chiroinositolo ha mostrato di avere dei grossi effetti positivi sul ritmo di metabolizzazione e assorbimento del glucosio da parte delle cellule muscolari. È stato notato che 50mg sono una dose efficace insieme a un pasto.
4-idrossi-isoleucina: è un amminoacido presente naturalmente in alcuni alimenti. La fonte più efficiente è un’erba di nome fieno greco. I semi di fieno greco contengono lo 0,8-1,0% di 4-idrossi-isoleucina. Questo significa che i semi macinati possono fornire fino a 10 mg per grammo. Il 4-idrossi-isoleucina influenza il trasporto di glucosio e amminoacidi influenzando positivamente la produzione di insulina da parte delle cellule pancreatiche beta. Quando si assumono 45-90mg di questa sostanza insieme a un macronutriente il rilascio di insulina può aumentare anche del 100% traducendosi in un aumento significativo del trasporto dei nutrienti e del loro assorbimento nelle fibre muscolari.
Acido Alfa Lipoico: L’acido alfa lipoico è un composto che ricopre un ruolo chiave nel metabolismo energetico cellulare della maggior parte degli esseri viventi, a partire dai batteri per arrivare fino all’uomo. Sono inoltre note le sue spiccate proprietà antiossidanti. Per questa ragione, l’assunzione di acido alfa lipoico sotto forma di integratore alimentare, può essere di grande utilità per attivare queste funzioni di vitale importanza per l’organismo. L’acido alfa lipoico non è in grado solo di incrementare l’efficienza dell’insulina, ma può migliorare anche il trasporto del glucosio all’interno delle cellule utilizzando vie indipendenti da quelle dell’insulina stessa. L’acido alfa lipoico possiede la proprietà di ridurre la resistenza all’insulina, e la esercita ottimamente ad un dosaggio giornaliero di 200mg.
Esistono anche dei farmaci (leggi anche Diabete: metformina e altri farmaci) per il miglioramento della sensibilità all’insulina:
Glucophage® (Metformina): aumenta il numero e la sensibilità dei siti recettori dell’Insulina; diminuisce la quantità di glucosio/zucchero assorbita dall’intestino; diminuisce la quantità di glucosio/zucchero prodotta dal fegato (una fonte per la produzione di glucosio epatico sono gli amminoacidi/proteine). Le dosi si aggirano intorno ai 500/850mg 1-2 volte al giorno.
Avandia® (Rosiglitazone): incrementa il numero e la sensibilità dei siti recettori cellulari per l’insulina. Le dosi si aggirano intorno ai 2-8mg 1-2 volte al giorno.
Avvertenze
A questo punto è giusto specificare l’uso dell’Insulina esogena e dei farmaci insulinici è molto pericolosa. Il suo/loro uso improprio può tradursi in coma, danno cerebrale e la morte. L’uso dell’Insulina esogena (o dei farmaci insulinici) andrebbe presa in considerazione solo in presenza di una supervisione medica o di un preparatore qualificato! L’uso improprio di Insulina può causare diabete e iperglicemia.
Altri effetti collaterali dell’Insulina comprendono:
- Sudorazione improvvisa
- Palpitazioni
- Leggero eccitamento
- Confusione mentale
- Debolezza
- Rabbia
- Visione distorta
- Difficoltà di parola.
Questi effetti collaterali indicano che non sono stati assunti abbastanza carboidrati e non abbastanza
spesso.
E’ stato considerato saggio da parte di alcuni atleti il tenere una fiala di Glucagone (un antagonista dell’Insulina) a portata di mano nel caso si presentasse i sintomi sopra elencati.
Dal momento che la somministrazione esogena di Insulina provoca una soppressione della secrezione endogena di questo ormone, molti atleti, al termine di un ciclo di Insulina, intraprendono una fase di “rigenerazione pancreatica” con farmaci in grado di stimolare la secrezione pancreatica di Insulina. Il più utilizzato è il Glipizide, una molecola appartenente alla famiglia delle sulfaniluree, dotata di azione ipoglicemizzante ed utilizzata come farmaco per la cura del diabete. È considerata una sulfanilurea di seconda generazione, simile alla glibenclamide, ma caratterizzata da una durata d’azione più breve. L’azione ipoglicemizzante è proprio dovuta al fatto che la Glipizide favorisce il rilascio di Insulina dalle cellule β del pancreas. In Italia il farmaco è venduto dalla società farmaceutica Pfizer con il nome commerciale di Minidiab nella forma di compresse divisibili contenenti 5mg di principio attivo. Il suo uso può portare alla comparsa di effetti collaterali quali dispepsia, nausea, vomito, gastralgia, dolore addominale, diarrea o stipsi. Più raramente sono stati segnalati casi di epatotossicità con incremento delle transaminasi (AST, ALT e fosfatasi alcalina), epatite acuta ed ittero colestatico. Ovviamente, se i carboidrati ingeriti sono insufficienti, l’ipoglicemia è una tipica conseguenza dell’uso di Glipizide.
CONCLUSIONE
Abbiamo parlato del ruolo, della funzione e della interazione dell’ormone della crescita, del fattore di crescita insulino-simile 1 (IGF-1) e dell’Insulina per la crescita dei tessuti. Abbiamo imparato che esiste una sinergia profonda tra questi tre peptidi e altre sostanze chimiche. Abbiamo parlato della storia di questi ormoni, delle loro applicazioni cliniche e per il miglioramento delle prestazioni. Abbiamo anche parlato dei loro possibili effetti collaterali, e della pericolosità sul breve termine dell’uso improprio dell’Insulina. Sperando che quanto detto aiuti l’atleta a ragionare oggettivamente e non emotivamente nella continua ricerca dell’”elisir” di crescita. Si spera anche che i presunti atleti o aspiranti tali, con un margine di crescita naturale sfruttato al 40-50% (o meno), con un esperienza in sala pesi di un anno (o meno) e con la convinzione che la chimica sia la soluzione a tutto e che non c’è “tempo da perdere”, capiscano che il progresso nel Body Building va di pari passo con il mantenimento di una salute ottimale e con una profonda conoscenza dell’allenamento e della nutrizione.
Gabriel Bellizzi
Riferimenti bibliografici
- Bryan Haycock, Crescete più di quanto previsto dalla natura. Meccanismi di azione dell’ormone della crescita (GH) e del fattore di crescita insulino-simile ( IGF-1). Parte 1 e 2, Olympian’s News.
- A.L.Rea., Chemical Muscle Enhancement.
- A.L.Rea., Costruire la bestia perfetta (Chemical Muscle Enhancement II).
- Wilson et al., Subcutaneous Versus Intramuscular Growth Hormone Therapy: Growth and Acute Somatomedin Response. Pediatrics. 1985 Sep;76(3):361-4.
- de la Motte et al., Pharmacokinetics of human growth hormone administered subcutaneously with two different injection systems. Arzneimittelforschung. 2001;51(7):613-7.
________________
Quest’opera è distribuita con Licenza Creative Commons Attribuzione – Non commerciale – Non opere derivate 3.0 Italia.