Come annunciato nell’articolo su i presidi farmacologici usati contro il diabete di tipo 2 (leggi Diabete: metformina e altri farmaci), ora parlerò di alcuni integratori alimentari che possono coadiuvare l’azione farmacologica o migliorare lo stato di salute generale sia nei diabetici ma anche nei soggetti sani, specialmente della tiamina (vit B1) e del suo ruolo nella sindrome diabetica.
Vorrei fare una premessa sul diabete e sull’approccio terapeutico della medicina moderna. Attualmente intorno al diabete ruota un giro d’affari di svariati milioni di euro, è un vero e proprio business al pari di quello dell’industria del cancro, dell’AIDS, ecc e nonostante gli altrettanti milioni investiti in ricerca e sviluppo pare non esserci mai una via d’uscita… mai una soluzione concreta ai problemi; c’è da chiedersi se tutto questo è frutto di una sfiga reiterata oppure è volutamente studiato a tavolino. La valutazione del diabete viene fatta ancora sulla base dei valori di emoglobina glicata, ma spesso nei soggetti diabetici questo valore può fuorviare il medico; tra i sintomi del diabete non ci sono soltanto valori emoglucidici alterati, bensì possono esserci anche dolori neuropatici periferici (inutilmente curati con sedativi e antidolorifici). Sono proprio quest’ultimi che vengono trascurati, poichè essi non migliorano in seguito alle terapie standard (insulina compresa) volte ad abbassare i livelli glicemici; il diabete è visto come un difetto metabolico da correggere, e quindi la pratica medica prevede di forzare lo zucchero ad entrare nelle cellule (attraverso l’uso di insulina, secretogeni, ecc), e come dimostrato anche alla luce dello studio ACCORD, tale “modus operandi” è stato causa di svariati decessi sopratutto per complicanze cardiovascolari. Dato che in un modo o nell’altro l’eccesso di zucchero deve essere smaltito, il nostro organismo autonomamente lo smaltisce attraverso le urine (glicosuria), e solo recentemente la farmacologia ha sviluppato alcuni farmaci noti come “inibitori del trasporto del sodio-glucosio” che amplificano la glicosuria. Come ho detto prima, la pratica medica tradizionale spinge nello stipare questo zucchero nelle cellule forzando i sistemi di membrana a lasciarlo entrare, ma questa forzatura (in carenza di tiamina) porta non pochi problemi poichè tale zucchero pompato nelle cellule non verrà metabolizzato correttamente, e ciò aumenta la formazione di AGE (Advanced Glycation End-product) detti anche “prodotti di glicosilazione avanzata” (leggi Link1 per approfondire), che rappresentano la causa di gravi problemi nel paziente diabetico[13] (ma anche nei soggetti sani).
INTEGRATORI ALIMENTARI
Tra i supplementi troviamo:
- Tiamina (vit. B1)
- Acido alfa-lipoico
- Biotina e Cromo
- Carnitina (l-carnitina, acetil-l-carnitina, ecc)
- Coenzima Q10
- Berberina
- Omega 3
- Magnesio citrato e altri tamponi
Tiamina (vit. B1)
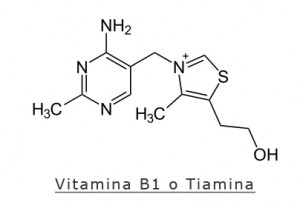 La tiamina (nella forma difosfato) funge da coenzima per le transchetolasi e le decarbossilasi, quest’ultime rappresentate dal complesso delle piruvato deidrogenasi (PDC) e il complesso α-chetoglutarato deidrogenasi (AKGD), due enzimi essenziali per il metabolismo glucidico. In breve il PDC converte il piruvato in acetil-CoA, fattore centrale nel ciclo di Krebs per produrre energia con formazione di CO2; l’AKGD invece è il fattore chiave e allo stesso tempo limitante nel ciclo di Krebs, provvede alla conversione dell’ α-chetoglutarato in succinil-CoA come prodotto intermedio nel ciclo di Krebs. La carenza o assenza di tiamina rende impossibile la reazione aerobica di decarbossilazione del piruvato, che verrà convertito in acido lattico (con conseguente acidosi metabolica).
La tiamina (nella forma difosfato) funge da coenzima per le transchetolasi e le decarbossilasi, quest’ultime rappresentate dal complesso delle piruvato deidrogenasi (PDC) e il complesso α-chetoglutarato deidrogenasi (AKGD), due enzimi essenziali per il metabolismo glucidico. In breve il PDC converte il piruvato in acetil-CoA, fattore centrale nel ciclo di Krebs per produrre energia con formazione di CO2; l’AKGD invece è il fattore chiave e allo stesso tempo limitante nel ciclo di Krebs, provvede alla conversione dell’ α-chetoglutarato in succinil-CoA come prodotto intermedio nel ciclo di Krebs. La carenza o assenza di tiamina rende impossibile la reazione aerobica di decarbossilazione del piruvato, che verrà convertito in acido lattico (con conseguente acidosi metabolica).
Per comprendere l’importanza della tiamina basta vedere dove è presente e in che funzioni presiede:
- presente nelle membrane sinaptiche cerebrali e nel tessuto nervoso[3–7]
- implicata nel metabolismo energetico e nella degrazione degli scheletri carboniosi dello zucchero intracellulare[8–10]
- nell’attivazione del sistema immunitario
ed altro ancora.
Nei diabetici i livelli di tiamina sono estremamente bassi anche a causa degli alti livelli di glucosio nel sangue che ne aumentano l’escrezione urinaria di circa 25 volte rispetto al normale causandone una carenza acuta simile alla sindrome Beriberi; il dr. Thornalley nel 2005 vide che i tipici sintomi che si riscontrano (neuropatia periferica, danni renali, retinopatia, problemi cardiovascolari[11], ecc) sono dovuti a questa severa carenza.[1] La somministrazione di elevate dosi di tiamina unite alla riduzione di carboidrati (sopratutto raffinati) nella dieta, può far regredire tali sintomi compreso la dislipidemia. Inoltre, a causa dell’aumento degli AGE nei diabetici, avremo anche un aumento dei livelli di omocisteina; si è visto che nei pazienti diabetici nefropatici l’integrazione ad alte dosi di B6, B9 e B12 portava effettivamente alla riduzione dei livelli di omocisteina ma la nefropatia peggiorava cosi come aumentavano i problemi cardiovascolari. Ciò si può spiegare in questo modo: le alti dosi di B9 influenzano la funzionalità dell’RFC-1, che oltre a trasportare il folato trasporta anche i metaboliti TMP e TPP della tiamina, quest’ultima risulta carente nella nefropatia diabetica poichè la sua ricaptazione renale è compromessa; dunque dati gli alti livelli di folato (che si lega all’RFC-1) si va a creare una competizione sul trasporto del TMP e TPP (aggravando la carenza di tiamina) nelle cellule degli organi sensibili quali il rene e il tessuto vascolare, inoltre le concentrazioni plasmatiche di tiamina sono inversamente proporzionali a quelle delle molecole di adesione cellulare vascolare (VCAM-1), ed ecco il perchè la nefropatia e i problemi cardiovascolari peggioravano.[2][14]
L’integrazione di B1 e B6 o solo B6 ha mostrato di ridurre gli AGE nei diabetici nefropatici, ma ha incrementato la quantità di peptide C.[20]
I livelli di tiamina sono inversamente legati a quelli del lattato e la somministrazione di insulina in tale condizione riduce ulteriormente i livelli di tiamina, la stessa sindrome di Wernicke può peggiorare in presenza di chetoacidosi metabolica.[16][17]
In un analisi più recente sempre di Thornalley & co. si evince che le alte concentrazioni di glucosio nel sangue inibiscono anche l’espressione del THTR-1 e THTR-2 (altri due trasportatori della tiamina) nell’epitelio del tubulo renale prossimale, dove avviene la maggiore ricaptazione della tiamina a livello renale. Nei diabetici la diminuzione del recupero della tiamina sulle 24 ore è molto elevata, in cui sussiste un progressivo declino della funzionalità dell’epitelio del tubulo prossimale che porta all’aumento della clearance della tiamina.[12][14]
Da uno studio su modello animale è emerso inoltre una riduzione dell’attività dell’enzima transchetolasi negli eritrociti, polmone, rene, milza e fegato a seguito della carenza alimentare di tiamina, quest’ultima verificatasi in maniera preponderante negli altri tessuti (circa -70%) ma meno marcata nel cervello (-31%) e nel cuore (-28%) dopo solo 4 settimane, tale per cui anche la riduzione dell’attività dell’enzima transchetolasi era meno marcata in questi due organi; ciò perchè in tali tessuti una carenza seria di tiamina porta a sindromi anche gravi (le varie forme di beriberi e la sindrome di Wernicke), dunque in un qualche modo essi sono maggiormente “protetti” verso tale carenza.[15] Comunque i livelli assoluti di tiamina nel tessuto cerebrale sono di molto inferiori rispetto ad altri organi, segno del fatto che esso è più sensibile alla deficienza di tiamina.
Da due studi randomizzati in doppio cieco placebo controllati sono emersi risultati discordanti:
- nel 2009 lo studio pilota di Rabbani & co. condotto su 40 pazienti diabetici, mostrava come l’integrazione di 300mg/die di tiamina per oltre 3 mesi facesse regredire la microalbuminuria[18]
- nel 2010 in uno studio olandese di Alkhalaf & co. in cui venne usata benfotiamina al dosaggio di 900mg/die in diabetici nefropatici emersero risultati opposti al precedente, ossia che a fronte dell’aumento dei livelli plasmatici di tiamina, l’escrezione urinaria di albumina e il marker del danno tubulare durante le 24 ore non erano diminuiti[19]
Tale discrepanza può essere dovuta a tanti fattori (diversi valori basali, dieta, luogo geografico dei soggetti, ecc), ma in due review successive del 2011 e 2012 emerge una concordanza di opinioni sul fatto che la tiamina (la sua carenza anzi) è un fattore centrale nell’insorgenza delle problematiche (tra cui anche il cancro) causate dal diabete, e che dunque la sua integrazione può migliorare le funzioni endoteliali e ridurre lo stress ossidativo sia in un ambiente iperglicemico che normoglicemico.[21][22]
La mia personale impressione è che l’assunzione ad alti dosaggi di tiamina (cosi come di altre vitamine per periodi variabili tra loro) che presuppone di fatto una saturazione dei pathways, sia il modo attraverso cui nei soggetti deficitari si riesce a ristabilire un equilibrio che non c’è più, mentre nei soggetti sani (anche se in realtà lo stato di salute di ognuno di noi è solo apparentemente al 100%) può non solo portare concretamente al 100% il nostro stato di salute ma anche virtualmente superarlo in virtù del potenziamento dei sistemi metabolici…. sarebbe come far lavorare un motore sempre al massimo con i giusti livelli di olio che non perde mai le sue proprietà lubrificanti. Dunque non si tratta di andare oltre i limiti imposti dalla fisiologia, ma di centellinare le risorse atte a poter sfruttare lo sfruttabile dal potenziale umano.
Acido Alfa Lipoico (ALA)
 L’acido Alfa Lipoico riveste un ruolo importante come co-enzima nel ciclo di Krebs, svolge un ruolo antiossidante esternamente e internamente alla cellula poichè è idrosolubile e liposolubile; aumenta le riserve intracellulari di glutatione e i livelli di CoQ10, forma complessi stabili con il rame, manganese e zinco e ha effetti chelanti. Inoltre provvede anche alla rigenerazione dell’acido ascorbico, questo può ridurre l’α-tocoferossilico (un radicale del α-tocoferolo) di nuovo in α-tocoferolo (vit. E). Proprio su quest’ultima proprietà uno studio randomizzato placebo controllato[23] di 2 mesi su 85 diabetici in emodialisi ha voluto verificare le proprietà dell’ALA e della Vit. E singolarmente o in accoppiata. Alle dosi di 400ui di tocoferolo e 600mg di ALA non è stata osservata riduzione della malondialdeide (un marker dello stress ossidativo) ne con assunzione singola dei due composti ne in quella combinata; probabilmente sia le dosi che i tempi non erano adeguati affinchè ci fossero risultati significativi (cosa che in altri studi c’è stata) sopratutto per la vit. E in cui è stato visto che il suo potere antiossidante dipende dalla dose e dal tempo di somministrazione. Tuttavia a fronte dell’assenza di riduzione di malondialdeide, si è visto che i livelli di ALA e vit. E erano diminuiti, questo potrebbe significare che in base al dosaggio usato il bilancio finale era quasi in pari. É stata constatata però una riduzione dell’interleuchina-6 rispetto al gruppo placebo, che conferma le proprietà antiinfiammatorie dell’ALA e della vit E.
L’acido Alfa Lipoico riveste un ruolo importante come co-enzima nel ciclo di Krebs, svolge un ruolo antiossidante esternamente e internamente alla cellula poichè è idrosolubile e liposolubile; aumenta le riserve intracellulari di glutatione e i livelli di CoQ10, forma complessi stabili con il rame, manganese e zinco e ha effetti chelanti. Inoltre provvede anche alla rigenerazione dell’acido ascorbico, questo può ridurre l’α-tocoferossilico (un radicale del α-tocoferolo) di nuovo in α-tocoferolo (vit. E). Proprio su quest’ultima proprietà uno studio randomizzato placebo controllato[23] di 2 mesi su 85 diabetici in emodialisi ha voluto verificare le proprietà dell’ALA e della Vit. E singolarmente o in accoppiata. Alle dosi di 400ui di tocoferolo e 600mg di ALA non è stata osservata riduzione della malondialdeide (un marker dello stress ossidativo) ne con assunzione singola dei due composti ne in quella combinata; probabilmente sia le dosi che i tempi non erano adeguati affinchè ci fossero risultati significativi (cosa che in altri studi c’è stata) sopratutto per la vit. E in cui è stato visto che il suo potere antiossidante dipende dalla dose e dal tempo di somministrazione. Tuttavia a fronte dell’assenza di riduzione di malondialdeide, si è visto che i livelli di ALA e vit. E erano diminuiti, questo potrebbe significare che in base al dosaggio usato il bilancio finale era quasi in pari. É stata constatata però una riduzione dell’interleuchina-6 rispetto al gruppo placebo, che conferma le proprietà antiinfiammatorie dell’ALA e della vit E.
In un altro studio randomizzato in doppio cieco placebo controllato[24] soggetti con sindrome metabolica hanno avuto per un anno 600mg di ALA, 100ui di vit. E, ALA+E o placebo; il glucosio a digiuno e l’insulina plasmatica vennero misurati ogni 3 mesi mentre NEFA (acidi grassi non esterificati), marker infiammatori, adiponectina e vit. E ogni 6 mesi. Il livello dei NEFA non è diminuito significativamente nel gruppo ad ALA rispetto al placebo, mentre sono diminuiti significativamente nei gruppi ALA e ALA+E rispetto al gruppo con solo vit. E; il resto dei valori non sono cambiati in modo significativo.
Da uno studio tailandese randomizzato in doppio cieco placebo controllato[25] in cui si è voluto testare l’effettiva validità dell’ALA sul controllo glicemico e sullo stato ossidativo in pazienti diabetici, essi vennero suddivisi in 5 gruppi a 300, 600, 900 e 1200mg di ALA racemico (in accoppiata con metformina ed altri farmaci) e quello a placebo; è emerso un decremento del glucosio plasmatico dose-dipendente rispetto al placebo, quest’ultimo ha mostrato un leggero incremento del glucosio ematico a digiuno e dell’emoglobina glicata al termine dello studio (della durata di 6 mesi), tuttavia il controllo glicemico sembra essere alquanto ritardato e dunque poco sensibile a bassi dosaggi (300mg). Al pari di quanto avviene con la metformina per ciò che riguarda la proliferazione dei GLUT4, si è ipotizzato che l’ALA agisse allo stesso modo dell’insulina aumentanto il numero di GLUT4 muscolare cosi come la loro funzionalità incrementando l’uptake di glucosio a livello muscolare e adiposo; quindi l’accoppiata metformina + ALA risulta sinergica nel diabetico. L’ F2α isoprostano urinario (un marker della perossidazione dei lipidi) è stato misurato per controllare la condizione di stress ossidativo sistemico correlato alla condizione di nefropatia diabetica, esso non è variato nei gruppi ad ALA ma è incrementato di quasi il doppio nel gruppo placebo il che farebbe pensare ad un possibile effetto di soppressione dell’ALA sulla perossidazione lipidica nei diabetici. È stato misurato anche un altro marker (8-OHdG) che riguarda però il danno ossidativo sul DNA, esso risulta essere il doppio nei soggetti diabetici se comparato ai soggetti sani il che sta ad indicare che in tale condizione patologica sussiste una danno ossidativo sul DNA dovuto all’iperglicemia; tuttavia non è variato molto tra il gruppo placebo e i gruppi ad ALA. L’assenza di effetti contro i danni ossidativi al DNA dell’ALA farebbe pensare alla limitata capacità di quest’ultimo di far fronte alla continua produzione di ROS durante l’iperglicemia cronica nei diabetici, tuttavia il numero ridotto di soggetti per gruppo potrebbe essere una possibile spiegazione dell’ottenimento di tali risultati che non trovano conferma in altri studi condotti sulle proprietà antiossidanti dell’ALA; la breve emivita dell’ALA avrebbe dovuto far pensare che l’assunzione multidose esplicasse una maggiore azione inibitoria verso lo stress ossidativo, ma non è stato cosi. Il dato positivo che emerge dallo studio è senz’altro che gli effetti dell’ALA sono dose-dipendenti e che sono preferibili gli alti dosaggi (in tal caso 1200mg) per ottenere il controllo glicemico.
Biotina (vit. H) e Cromo
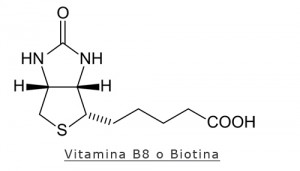 La biotina è un importante cofattore coinvolto in alcune reazioni di carbossilazione, la sua carenza è rara e una fonte di sintesi endogena è rappresentata dalla flora intestinale (oltre che essere presente in alcuni cibi); anche la carenza di cromo è alquanto rara, esso è coinvolto nel metabolismo glucidico.
La biotina è un importante cofattore coinvolto in alcune reazioni di carbossilazione, la sua carenza è rara e una fonte di sintesi endogena è rappresentata dalla flora intestinale (oltre che essere presente in alcuni cibi); anche la carenza di cromo è alquanto rara, esso è coinvolto nel metabolismo glucidico.
 Veniamo ora al loro uso in pazienti diabetici che presentano o meno dislipidemia. In uno studio randomizzato in doppio cieco placebo controllato[26] su pazienti con diabete di tipo 2, si è voluto valutare l’effettiva validità dell’uso di biotina e cromo picolinato sulla riduzione dei livelli di emoglobina glicata e di glucosio a digiuno, e secondariamente valutare le modificazioni nei livelli di lipidi e lipoproteine. In linea con altri studi che hanno dato parere positivo sul controllo glicemico, anche in questo è stato osservato un significativo decremento dell’emoglobina glicata e del glucosio ematico, ma anche dei livelli di lipidi e lipoproteine nei pazienti diabetici con ipercolesterolemia; su quest’ultima analisi occorrebbero ulteriori studi poichè tale studio non ha tenuto conto dei farmaci anticolesterolemici assunti dai soggetti ne dei livelli basali di colesterolo ed inoltre la durata dello studio è di soli 90 giorni, mentre occorrerebbe un periodo più lungo di indagine.
Veniamo ora al loro uso in pazienti diabetici che presentano o meno dislipidemia. In uno studio randomizzato in doppio cieco placebo controllato[26] su pazienti con diabete di tipo 2, si è voluto valutare l’effettiva validità dell’uso di biotina e cromo picolinato sulla riduzione dei livelli di emoglobina glicata e di glucosio a digiuno, e secondariamente valutare le modificazioni nei livelli di lipidi e lipoproteine. In linea con altri studi che hanno dato parere positivo sul controllo glicemico, anche in questo è stato osservato un significativo decremento dell’emoglobina glicata e del glucosio ematico, ma anche dei livelli di lipidi e lipoproteine nei pazienti diabetici con ipercolesterolemia; su quest’ultima analisi occorrebbero ulteriori studi poichè tale studio non ha tenuto conto dei farmaci anticolesterolemici assunti dai soggetti ne dei livelli basali di colesterolo ed inoltre la durata dello studio è di soli 90 giorni, mentre occorrerebbe un periodo più lungo di indagine.
I dosaggi di biotina e cromo dovrebbero attestarsi rispettivamente tra 5-15mg/die e 200-1000μg/die nei soggetti diabetici, come soglia sicura in cui no si dovrebbero riscontrare problemi.
L-Carnitina e Acetil-l-carnitina
 La carnitina è un aminoacido derivato da altri due aminoacidi (lisina e metionina) e anch’essa svolge un ruolo importante nel metabolismo glucido e lipidico. Essa ha il ruolo di carrier degli acidi grassi attivati verso l’interno della cellula nello spazio mitocondriale. Normalmente è presente sottoforma di carnitina ma quest’ultima, ad opera dell’enzima mitocondriale l-acetilcarnitina transferasi con il gruppo acetil-CoA, forma Acetil-l-carnitina. Dunque esistono due tipi di integratori, l-carnitina e acetil-l-carnitina; dall’assunzione del primo una parte viene convertita ad acetil-l-carnitina, essa riduce lo stress ossidativo e il danno neuronale riducendo i livelli plasmatici di glutammato (per approfondire leggi Link2)
La carnitina è un aminoacido derivato da altri due aminoacidi (lisina e metionina) e anch’essa svolge un ruolo importante nel metabolismo glucido e lipidico. Essa ha il ruolo di carrier degli acidi grassi attivati verso l’interno della cellula nello spazio mitocondriale. Normalmente è presente sottoforma di carnitina ma quest’ultima, ad opera dell’enzima mitocondriale l-acetilcarnitina transferasi con il gruppo acetil-CoA, forma Acetil-l-carnitina. Dunque esistono due tipi di integratori, l-carnitina e acetil-l-carnitina; dall’assunzione del primo una parte viene convertita ad acetil-l-carnitina, essa riduce lo stress ossidativo e il danno neuronale riducendo i livelli plasmatici di glutammato (per approfondire leggi Link2)
L’integrazione di acetil-l-carnitina su periodi anche discretamente lunghi ha mostrato di poter ridurre alcuni fattori di rischio cardiovascolari come la pressione arteriosa, aumentare i livelli plasmatici di adiponectina, ed anche di migliorare la sensibilità insulinica e la tolleranza al glucosio nei soggetti diabetici di tipo 2.[27][28]
I dosaggi di l-carnitina dovrebbero oscillare tra 500mg e 1500mg al giorno in base alle necessità del soggetto tenendo anche conto che la sua emivita è di 4 ore e 20 minuti. Nei diabetici si è arrivati anche a 2g ma per via parenterale, il che evita anche la produzione di metaboliti (N-ossido-trimetilammina o TMAO) da parte della flora intestinale che nei soggetti diabetici nefropatici potrebbe rappresentare un problema.
Coenzima Q10 (CoQ10)
 Tale composto è coinvolto nei meccanismi aerobici di produzione di energia e nelle reazioni di ossido-riduzione, ha proprietà antiossidant; inoltre la sua produzione viene inibita a seguito dell’uso di statine.
Tale composto è coinvolto nei meccanismi aerobici di produzione di energia e nelle reazioni di ossido-riduzione, ha proprietà antiossidant; inoltre la sua produzione viene inibita a seguito dell’uso di statine.
In pazienti diabetici la supplementazione, insieme ad altri composti per il controllo glicemico, ha mostrato di migliorare la secrezione insulinica.[29]
I dosaggi nel diabetico dovrebbe oscillare tra 30-200mg/die, che rappresenta un buon compromesso.
Berberina
 La berberina è un alcaloide derivato dalle piante del genere Berberis, è stato visto che tale sostanza esercita un’azione positiva sulle complicanze del diabete tra cui anche l’osteoporosi; infatti aumenta l’attività osteoblastica attraverso la selettività che tale molecola presenta sui recettori PPAR-γ degli adipociti anzichè di quelli presenti sugli osteoblasti (selettività che manca invece nei tiazolidinedioni e che può condurre a osteoporosi) e sul miglioramento della sensibilità insulinica e dell’infiammazione sistemica, fattori che agevolano l’osteogenesi. Riduce anche la formazione di AGEs e inibisce la secrezione di PTH migliorando i marker dell’osteocalcina, che a sua volta stimola la secrezione di insulina e adiponectina.[30] Inoltre è stato visto anche un effetto positivo della berberina sulla retinopatia diabetica e sulla conseguente risposta leucocitaria in vitro.[31]
La berberina è un alcaloide derivato dalle piante del genere Berberis, è stato visto che tale sostanza esercita un’azione positiva sulle complicanze del diabete tra cui anche l’osteoporosi; infatti aumenta l’attività osteoblastica attraverso la selettività che tale molecola presenta sui recettori PPAR-γ degli adipociti anzichè di quelli presenti sugli osteoblasti (selettività che manca invece nei tiazolidinedioni e che può condurre a osteoporosi) e sul miglioramento della sensibilità insulinica e dell’infiammazione sistemica, fattori che agevolano l’osteogenesi. Riduce anche la formazione di AGEs e inibisce la secrezione di PTH migliorando i marker dell’osteocalcina, che a sua volta stimola la secrezione di insulina e adiponectina.[30] Inoltre è stato visto anche un effetto positivo della berberina sulla retinopatia diabetica e sulla conseguente risposta leucocitaria in vitro.[31]
Omega 3 (ω-3 o PUFA)
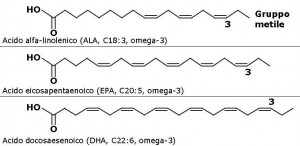 Gli omega 3 fanno parte degli acidi grassi essenziali presenti nella membrana cellulare, si dividono in acido α-linolenico, acido eicosapentaenoico (EPA), acido docosaesaenoico (DHA), quest’ultimi due sintetizzabili in piccole dosi a partire dall’α-linolenico. Il loro ruolo come integratore utile a contrastare le complicanze del diabete sono state ben studiate, ad esempio in caso di bambini insulino-resistenti è stato visto che l’integrazione di omega 3 riduceva i valori dei trigliceridi e migliorava il BMI.[32]
Gli omega 3 fanno parte degli acidi grassi essenziali presenti nella membrana cellulare, si dividono in acido α-linolenico, acido eicosapentaenoico (EPA), acido docosaesaenoico (DHA), quest’ultimi due sintetizzabili in piccole dosi a partire dall’α-linolenico. Il loro ruolo come integratore utile a contrastare le complicanze del diabete sono state ben studiate, ad esempio in caso di bambini insulino-resistenti è stato visto che l’integrazione di omega 3 riduceva i valori dei trigliceridi e migliorava il BMI.[32]
In un altro studio randomizzato in doppio cieco placebo controllato l’integrazione per 12 settimane di omega 3 ha innalzato i livelli plasmatici di EPA e DHA portando alla riduzione del livello dei trigliceridi ma nessun miglioramento sulla perdita di peso durante un programma di dimagrimento, il campione analizzato è troppo ristretto.[33]
Ma in un altro studio invece emerge che la supplementazione con 2gr di EPA per 12 settimane ha significativamente migliorato la sensibilità all’insulina e ridotto la glicemia a digiuno nonchè l’emoglobina glicata in pazienti diabetici.[34]
Da uno studio di coorte si palesa un dato alquanto strano, ossia in pazienti diabetici con problemi coronarici in cui sussiste il rischio d’infarto, è stato visto che alte dosi di PUFA possono ridurre questo problema; altresì però tale rischio pare aumentare invece nei soggetti non diabetici che assumono alte dosi di PUFA.[35] Ovviamente limitazioni dello studio a parte, non ha effettivamente senso l’integrazione ad alte dosi di omega 3 se non per alcuni motivi, di norma 2-3gr sono il quantitativo giusto, più importante è invece mantenere il giusto rapporto tra ω-3 e ω-6.
Magnesio citrato
Il magnesio è uno dei minerali coinvolti in numerosi processi metabolici ed enzimatici volti alla produzione di energia, come nel metabolismo del glucosio e dell’insulina modulando l’attività della tirosin-chinasi, fosforilasi-b-chinasi e GLUT4, partecipando alla traslocazione dello zucchero nella cellula. Nei diabetici o in coloro affetti da sindrome metabolica, la carenza di magnesio gioca un ruolo importante sul buono stato di salute; si è visto infatti che l’RDA del magnesio risulta essere troppo bassa negli individui sani (quindi immaginarsi nel diabetico), il che al pari delle vitamine sarebbe il caso di valutarne un effettiva integrazione (specialmente nei diabetici). È stato visto che bassi valori di magnesio provocano infiammazione cronica, il che può giocare un ruolo di rilievo nell’obesità, osteoporosi, aterosclerosi, ipertensione ed il tutto è aggravato dall’uso di diuretici. Il magnesio inoltre stimola la sintensi di ossido nitrico che potrebbe migliorare il tono vascolare mitigando l’ipertensione.[36]
 Ci sarebbero anche altre sostanze su cui si discute, come ad esempio la vit D. In uno studio in cui sono state somministare 1000ui/die di colecalciferolo, non sono stati riscontrati miglioramenti sugli indici glicemici in donne obese o in sovrappeso[37] mentre è stato visto che a 4000ui/die per 6 mesi il rapporto adiponectina/leptina si è ridotto cosi come la variazione insulinica, suggerendo che la vit D influenza direttamente o indirettamente la concentrazione di adiponectine indipendentemente dal grado di adiposità, siccome ne il BMI ne la circonferenza vita erano mutate. Si può affermare che la RDA per la vit D è sottostimata per i soggetti obesi, ma anche per i soggetti sani, dato che la soglia di tollerabilità è abbastanza alta.[38]
Ci sarebbero anche altre sostanze su cui si discute, come ad esempio la vit D. In uno studio in cui sono state somministare 1000ui/die di colecalciferolo, non sono stati riscontrati miglioramenti sugli indici glicemici in donne obese o in sovrappeso[37] mentre è stato visto che a 4000ui/die per 6 mesi il rapporto adiponectina/leptina si è ridotto cosi come la variazione insulinica, suggerendo che la vit D influenza direttamente o indirettamente la concentrazione di adiponectine indipendentemente dal grado di adiposità, siccome ne il BMI ne la circonferenza vita erano mutate. Si può affermare che la RDA per la vit D è sottostimata per i soggetti obesi, ma anche per i soggetti sani, dato che la soglia di tollerabilità è abbastanza alta.[38]
In uno studio iraniano randomizzato in cieco placebo controllato su 54 bambini diabetici di tipo 1A al primo stadio è stato visto che l’utilizzo di 1-alfa-idrossicolecalciferolo o semplicemente alfacalcidiolo (commercialmente noto come Deril® o Sefal® o il generico Dediol) esplica un ruolo protettivo sulle cellule β pancreatiche riducendo la risposta autoimmunitaria e la conseguente apoptosi. Il miglioramento sulla produzione insulinica a digiuno è stato lieve, ma comunque c’è stato; il colecalciferolo avendo un’emivita più lunga dell’alfacalcidiolo può dare evidenze più continuative sul controllo della risposta autoimmunitaria, giacchè sussiste un sistema di feedback sull’1-alfa idrossilasi si riduce anche la possibile tossicità esplicata da alti dosaggi di calcitriolo.[39] Ulteriori indagini e un campione più ampio di soggetti è necessario per capirne di più, ma ad ogni modo teniamo in considerazione anche il possibile ruolo che può assolvere la vitamina D verso il diabete di tipo 1.
CONCLUSIONE
Il presente articolo deve essere visto solo ed esclusivamente in chiave informativa, poichè non sostituisce ne costituisce un parere medico.
Detto ciò credo che i tasselli che contribuiscono al buono stato di salute siano tanti, e che sia bene esserne a conoscenza per fare scelte più ponderate sulla propria salute. Non dimentichiamo mai che l’alimentazione riveste un ruolo chiave nel diabetico tanto quanto nel soggetto sano o nello sportivo, quindi curandola bene si possono ottenere risultati strabilianti e ciò permette di usare meno farmaci nel controllo dei livelli glicemici ma anche e sopratutto meno insulina , che come sappiamo bene sul lungo periodo espone a non pochi rischi.
Per quanto riguarda l’integrazione alimentare nel diabetico, essa non può essere un fattore secondario alle terapie tradizionali poichè abbiamo visto che sopratutto le vitamine giocano un ruolo fondamentale nel metabolismo, nella produzione enzimatica, ormonale e dei neurotrasmettitori e che assicurano l’integrità cellulare. Tanto quando nel diabetico, anche nei soggetti sani (sedentari o sportivi) è importante l’apporto vitaminico, le differenze sussistono sui rispettivi fabbisogni (enormemente più elevati nei diabetici come nel caso della B1). Ogni protocollo integrativo/terapeutico è di competenza del vostro medico, quanto qui scritto ha il solo scopo di farvi dialogare in maniera più consapevole ed informata con egli e insieme cercare le strategie più opportune.
Per approfondire il ruolo metabolico di vitamine e minerali leggi anche l’articolo del prof. Gelli: Serotonina, vitamine, minerali, aminoacidi.
Enzo McKloud
RIFERIMENTI BIBLIOGRAFICI
[1] The potential role of thiamine (vitamin B1) in diabetic complications
[2] Vitamin B6, B9 and B12 in diabetic nephropathy – beware
[3] Subcellular localization and compartmentation of thiamine derivatives in rat brain
[4] Thiamine triphosphate synthesis in rat brain occurs in mitochondria and is coupled to the respiratory chain
[5] Thiamine as an integral component of brain synaptosomal membranes
[6] Thiamin function, metabolism, uptake, and transport
[7] Thiamine Deficiency Induced Neurochemical, Neuroanatomical, and Neuropsychological Alterations: A Reappraisal
[8] High-dose thiamine supplementation improves glucose tolerance in hyperglycemic individuals: a randomized, double-blind cross-over trial
[9] Effects of thiamine and benfotiamine on intracellular glucose metabolism and relevance in the prevention of diabetic complications
[10] Increased thiamine intake may be required to maintain thiamine status during weight loss in patients with type 2 diabetes
[11] Thiamine deficiency in diabetes mellitus and the impact of thiamine replacement on glucose metabolism and vascular disease
[12] Glucose-induced down regulation of thiamine transporters in the kidney proximal tubular epithelium produces thiamine insufficiency in diabetes
[13] Increased protein damage in renal glomeruli, retina, nerve, plasma and urine and its prevention by thiamine and benfotiamine therapy in a rat model of diabetes
[14] High prevalence of low plasma thiamine concentration in diabetes linked to a marker of vascular disease
[15] Are brain and heart tissue prone to the development of thiamine deficiency?
[16] The relationship between lactate and thiamine levels in patients with diabetic ketoacidosis
[17] Thiamine Deficiency as a Cause of Persistent Hyperlactatemia in a Parenteral Nutrition-Dependent Patient
[18] High-dose thiamine therapy for patients with type 2 diabetes and microalbuminuria: a randomised, double-blind placebo-controlled pilot study
[19] A Double-Blind, Randomized, Placebo-Controlled Clinical Trial on Benfotiamine Treatment in Patients With Diabetic Nephropathy
[20] Plasma AGE-peptides and C-peptide in early-stage diabetic nephropathy patients on thiamine and pyridoxine therapy
[21] The Impact of Thiamine Treatment in the Diabetes Mellitus
[22] Thiamine deficiency in diabetes mellitus and the impact of thiamine replacement on glucose metabolism and vascular disease
[23] Effect of alpha-lipoic acid and vitamin E supplementation on oxidative stress, inflammation, and malnutrition in hemodialysis patients
[24] The effect of lipoic acid and vitamin E therapies in individuals with the metabolic syndrome
[25] Glycemic and oxidative status of patients with type 2 diabetes mellitus following oral administration of alpha-lipoic acid: a randomized double-blinded placebo-controlled study
[26] Combination of chromium and biotin improves coronary risk factors in hypercholesterolemic type 2 diabetes mellitus: a placebo-controlled, double-blind randomized clinical trial
[27] Ameliorating hypertension and insulin resistance in subjects at increased cardiovascular risk: effects of acetyl-L-carnitine therapy
[28] L-Carnitine Improves Glucose Disposal in Type 2 Diabetic Patients
[29] The reduced form of coenzyme Q10 improves glycemic control in patients with type 2 diabetes: an open label pilot study
[30] Possible therapeutic potential of berberine in diabetic osteopathy
[31] Leukocytes from diabetic patients kill retinal endothelial cells: effects of berberine
[32] Omega-3 polyunsaturated fatty acids reduce insulin resistance and triglycerides in obese children and adolescents
[33] Dietary supplementation with long chain omega-3 polyunsaturated fatty acids and weight loss in obese adults
[34] Eicosapentaenoic acid improves insulin sensitivity and blood sugar in overweight type 2 diabetes mellitus patients: a double-blind randomised clinical trial
[35] Dietary intake of n-3 long-chain polyunsaturated fatty acids and risk of myocardial infarction in coronary artery disease patients with or without diabetes mellitus: a prospective cohort study
[36] Magnesium in Disease Prevention and Overall Health
[37] Does vitamin D3 supplementation improve glucose homeostasis in overweight or obese women? A double-blind, randomized, placebo-controlled clinical trial
[38] Correcting vitamin D insufficiency improves insulin sensitivity in obese adolescents: a randomized controlled trial
[39] A randomized placebo-controlled trial of alphacalcidol on the preservation of beta cell function in children with recent onset type 1 diabetes
________________

Quest’opera è distribuita con Licenza Creative Commons Attribuzione – Non commerciale – Non opere derivate 3.0 Italia.