Dopo l’articolo sulla presunta infondata associazione tra alti livelli di testosterone e cancro alla postata (leggi Cancro alla prostata: Testosterone assolto?), propongo di trattare un altro argomento che in parte è collegato al precedente; ossia gli estrogeni con il loro ruolo di mediazione nell’inibizione dell’asse HPTA, e quello del Clomifene citrato (Clomid).
 Il Clomifene è come ben sappiamo un noto antiestrogeno (che interagisce al pari di un debole estrogeno su i recettori bersaglio) facente parte della famiglia dei SERM (Selective Estrogen Receptor Modulator), ma a differenza di altri antiestrogeni esso non esplica una forte azione recettoriale periferica, bensì centrale a livello ipotalamico (e indirettamente ipofisario). Ciò spiega anche in parte il fallimento di tale molecola intesa come tradizionale antiestrogeno, onde evitare gli spiacevoli effetti da eccesso estrogenico in seguito ad assunzione esogena di androgeni.
Il Clomifene è come ben sappiamo un noto antiestrogeno (che interagisce al pari di un debole estrogeno su i recettori bersaglio) facente parte della famiglia dei SERM (Selective Estrogen Receptor Modulator), ma a differenza di altri antiestrogeni esso non esplica una forte azione recettoriale periferica, bensì centrale a livello ipotalamico (e indirettamente ipofisario). Ciò spiega anche in parte il fallimento di tale molecola intesa come tradizionale antiestrogeno, onde evitare gli spiacevoli effetti da eccesso estrogenico in seguito ad assunzione esogena di androgeni.
Il clomifene citrato viene usato per indurre nella donna l’ovulazione (un alternativa a bassi sides è rappresentata dal letrozolo[1][17]), ed inoltre pare diminuire la concentrazione plasmatica di IGF-1 aumentando quella di IGFBP-1 nelle donne con ovaio policistico (con riduzione del 56,5% del rapporto IGF-1 : IGFBP-1).[16]
L’uso del clomifene sugli uomini non è pratica usuale e dunque non ci sono nemmeno molti studi eseguiti su di essi.
Veniamo al meccanismo fisiopatologico alla base della regolazione e del mantenimento dell’omeostasi ormonale ad opera dell’asse HPTA (Hypothalamic Pituitary Testes Axis), cosa e perchè accade, quando quest’ultimo smette di funzionare.[2][3][4][5]
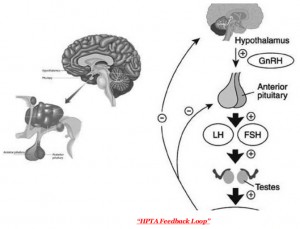
L’asse HPTA detto anche asse ipotalamo-ipofisi-gonadi rappresenta un sistema di stimolazione/inibizione degli ormoni prodotti dalle rispettive strutture:
- Ipotalamo -> GnRH (Gonadotropin Releasing Hormone o Ormone di rilascio delle gonadotropine)
- Ipofisi -> LH (Ormone luteinizzante) e FSH (Ormone follicolo stimolante)
- Gonadi -> Testosterone, androstenedione, DHEAS, Inibina
Il processo di inibizione avviene poichè l’azione degli androgeni (mediata dagli estrogeni) a livello dell’ipotalamo ma anche dell’ipofisi, innesca un feedback negativo che porta al controllo o inibizione della stimolazione.
Quando sussiste una condizione di ipogonadismo secondario in cui i valori di testosterone, LH ed FSH sono bassi (ad esempio in seguito ad utilizzo prolungato di androgeni esogeni, nella post cessazione) gli estrogeni attuano e mantengono vivo per un periodo discretamente lungo l’inibizione del rilascio di GnRH, poichè interagiscono con i rispettivi recettori presenti sull’ipotalamo. L’introduzione esogena di HCG o gonadotropina corionica (leggi l’articolo qui) che funge da sostituto dell’LH ipofisario, farebbe aumentare i livelli di testosterone nel breve periodo[20], ma da un lato non sortirebbe effetti sulla “disinibizione” ipotalamica e dall’altro sul controllo dell’aromatizzazione a cui va incontro il testosterone prodotto (quindi ci si ritrova in una situazione peggiore di quella iniziale).
Facciamo un breve excursus sulle principali situazioni di mal funzionamento dell’HPTA in cui si riscontrano bassi livelli di testosterone:
- IPOgonadismo IPERgonadotropico
- IPOgonadismo IPOgonadotropico
Nel primo caso avremo alti livelli di gonadotropine e bassi livelli sierici di testosterone, il che sta ad indicare un possibile danno (o una desensbilizzazione all’LH) alle cellule di Leydig che presentano una bassa risposta alla stimolazione gonadotropica, sia essa endogena (LH) o esogena (HCG).
Nel secondo caso (IPOgonadismo IPOgonadotropico) le problematiche risiedono a monte, ossia all’ipofisi e all’ipotalamo. In tal caso si assiste a bassi livelli sierici di testosterone uniti a basi livelli di LH ed FSH. I bassi livelli di gonadotropine possono essere influenzati da bassi livelli di GnRH qualora il problema risiedesse nell’ipotalamo. Quindi qui le problematiche possono essere varie:
- tumore all’ipofisi o all’ipotalamo
- sostanze psicoattive (ad esempio le metamfetamine e derivati), estrogeni (anche nel caso di rapporto T/E sfavorevole[18]) e DHT
- deficienza congenita di GnRH o LH, FSH
- altri fattori che alterano il meccanismo di controllo ipotalamico
Capire l’origine del problema e la causa non è tanto facile, dunque si va un po per tentativi. Prima ho parlato della somministrazione di HCG, bene nel caso in cui sussiste un IPOgonadismo IPOgonadotropico la somministrazione di HCG serve essenzialmente per valutare la risposta gonadale e assicurarci che quantomeno i nostri attributi funzionino. Ecco che entra in scena il Clomifene; anche con questo la risposta al nostro problema potrebbe non essere risolutiva. Esso va a legarsi (con affinità antagonista) ai recettori estrogenici ipotalamici depotenziando il segnale di feedback inibitorio dovuto agli estrogeni; ciò dunque porta all’aumento della produzione di GnRH che a loro volta stimolano la produzione di gonadotropine. Se ciò non avvenisse non avremmo comunque modo di capire se effettivamente il problema di mal funzionamento risieda sull’ipofisi o sull’ipotalamo. Un altro “test” consiste nella somministrazione di GnRH (commercialmente Kryptocur), esso va a stimolare il rilascio di gonadotropine ipofisarie.
Quindi incrociando i risultati del test con clomifene con quelli del kryptocur si può capire effettivamente se il danno sussiste a livello ipotalamico o ipofisario:
- se con il clomifene non otteniamo stimolazione ipofisaria, ma la otteniamo con il kryptocur, vuol dire che sussiste un danno a livello ipotalamico (anche di natura neurologica come nel caso di assunzione di MDMA[28][29][30][31])
- se invece non otteniamo stimolazione con il kryptocur, il danno è ipofisario
sulla natura del danno sia esso ipofisario o ipotalamico, occorrerebbero ulteriori indagini diagnostiche specialistiche.
Ora, tornando agli aspetti e alle situazioni che riguardano più da vicino l’uso di androgeni, sappiamo bene che l’uso di steroidi anabolizzanti (sopratutto se aromatizzabili) innesca il feedback negativo sull’HPTA quindi la situazione più diffusa (come risultante nel momento in cui si sospende l’assunzione) è quella di ipogonadismo ipogonadotropico, in cui non sussistono danni strutturali sull’ipotalamo o sull’ipofisi, ma solo elementi di inibizione ipotalamici-ipofisari (gli alti livelli di estrogeni).
Quindi il clomifene in tal contesto è ottimo nella “disinibizione” ipotalamica; la posologia si attesta su 100mg/day ma la durata oscilla fra 1-4 settimane.[14][15] Unendo un inibitore dell’aromatase si potenzia l’effetto del clomifene sopratutto perchè si riducono i tempi della terapia. Inoltre il clomifene interagisce anche a livello ipofisario, aumentadone la sensibilità alle GnRH.[15]
Il Clomifene si è dimostrato utile, efficace nel tempo e a basso costo, nonchè alternativo alla terapia sostitutiva sopratutto nei soggetti giovani, preservandone la fertilità e in tutti i casi di ipogonadismo ipogonadotropico idiopatico.[6][7][8][11][12][13][19]
Esiste anche un suo stereoisomero chiamato Enclomifene (Androxal), che presenta maggior attività antiestrogena con il vantaggio di una posologia minore.[9][10]
EFFETTI COLLATERALI
La maggior parte degli studi condotti sugli effetti collaterali indotti dall’uso di clomifene riguardano le donne in cui esso veniva usato per periodi abbastanza lunghi con lo scopo di indurre l’ovulazione come precedentemente accennato. Gli effetti collaterali sono di varia natura:
- Disturbi alla vista: nel complesso la loro incidenza negli studi clinici rappresenta l’1,5%[21][26][27]
- Reazioni psicotiche: in alcuni casi di donne in cura con clomifene, si sono verificati disturbi psicotici ma questo è un fenomeno raro e sparisce con l’interruzione della terapia. Inoltre alcuni soggetti erano già problematici di loro. Solitamente i sintomi compaiono 2 giorni dopo l’inizio della terapia[22][23][24]
- Transaminiti: un solo caso riportato in letteratura, di una donna somala; si tratta di un effetto collaterale molto raro[25]
CONCLUSIONI
Nel complesso il clomifene si è mostrato un prodotto efficace, sicuro e a basso costo (circa 5€ mutuabile dal SSN); utile quando l’intenzione è mantenere la fertilità come nei casi di ipogonadismo giovanile e si voglia agire per via “stimolativa” (disinibitiva a livello ipotalamico) endogena. Altresì oggi abbiamo a disposizione anche altri farmaci, come ad esempio il letrozolo (Femara) molto potente come antiaromatase, ma ovviamente i costi salgono rispetto al semplice clomifene.
Il ripristino dell’asse HPTA è sempre fattibile qualora non sussistono danni strutturali agli organi che lo compongono, anzi la ripresa può essere spontanea ma con tempi alquanto lunghi tali da inficiare il buono stato di salute psico-fisico generale; quindi accelerare i tempi di recupero attraverso la disinibizione/stimolazione è un fatto dovuto per un buono stato di salute generale.
Enzo McKloud
RIFERIMENTI BIBLIOGRAFICI
[1] Comparazione tra gli effetti del letrozolo e del clomifene citrato per l’induzione dell’ovulazione nelle donne infertili con sindrome dell’ovaio policistico
[2] Effect of Clomiphene on the Uptake of Estradiol by the Anterior Hypothalamus and Hypophysis
[3] PATHOPHYSIOLOGY COURSE – ENDOCRINE MODULE: Male Gonadal Disorders (Testicular Disorders & Clinical Conferences)
[4] Hypothalamic–pituitary–gonadal axis in two men with aromatase deficiency: evidence that circulating estrogens are required at the hypothalamic level for the integrity of gonadotropin negative feedback
[5] Aromatization Mediates Testosterone’s Short-Term Feedback Restraint of 24-Hour Endogenously Driven and Acute Exogenous Gonadotropin Releasing Hormone-Stimulated Luteinizing Hormone and Follicle-Stimulating Hormone Secretion in Young Men
[6] Clomiphene citrate is safe and effective for long-term management of hypogonadism
[7] Outcomes of clomiphene citrate treatment in young hypogonadal men
[8] Clomiphene citrate and testosterone gel replacement therapy for male hypogonadism: efficacy and treatment cost
[9] Enclomiphene, an estrogen receptor antagonist for the treatment of testosterone deficiency in men
[10] Clomiphene citrate and enclomiphene for the treatment of hypogonadal androgen deficiency
[11] Complete reversal of adult-onset isolated hypogonadotropic hypogonadism with clomiphene citrate
[12] Select patients with hypogonadotropic hypogonadism may respond to treatment with clomiphene citrate
[13] Idiopathic hypogonadotropic hypogonadism in a male runner is reversed by clomiphene citrate
[14] Use of clomiphene citrate to reverse premature andropause secondary to steroid abuse
[15] Impotence Related to Anabolic Steroid Use in a Body Builder Response to Clomiphene Citrate
[16] Clomiphene citrate increases insulin-like growth factor binding protein-1 and reduces insulin-like growth factor-I without correcting insulin resistance associated with polycystic ovarian syndrome
[17] Use of an aromatase inhibitor for induction of ovulation in patients with an inadequate response to clomiphene citrate
[18] Clomiphene citrate effects on testosterone/estrogen ratio in male hypogonadism
[19] Clomiphene increases free testosterone levels in men with both secondary hypogonadism and erectile dysfunction: who does and does not benefit?
[20] Anabolic steroid induced hypogonadism treated with human chorionic gonadotropin
[21] Association between Clomiphene Citrate and Visual Disturbances with Special Emphasis on Central Retinal Vein Occlusion: A Review
[22] Clomiphene citrate as a possible cause of a psychotic reaction during infertility treatment
[23] Psychotic illness during treatment with clomifen
[24] Clomiphene citrate as a possible cause of psychosis
[25] Transaminitis after treatment with clomiphene citrate: a case report
[26] Bilateral anterior uveitis associated with clomiphene citrate
[27] Visual disturbance secondary to clomiphene citrate
[28] Neuropsychotoxicity of Abused Drugs: Molecular and Neural Mechanisms of Neuropsychotoxicity Induced by Methamphetamine, 3,4-Methylenedioxymethamphetamine (Ecstasy), and 5-Methoxy-N,N-diisopropyltryptamine (Foxy)
[29] Neurotoxicity of drugs of abuse – the case of methylenedioxyamphetamines (MDMA, ecstasy), and amphetamines
[30] Preliminary evidence of hippocampal damage in chronic users of ecstasy
[31] The recreational drug ecstasy disrupts the hypothalamic-pituitary-gonadal reproductive axis in adult male rats
________________

Quest’opera è distribuita con Licenza Creative Commons Attribuzione – Non commerciale – Non opere derivate 3.0 Italia.