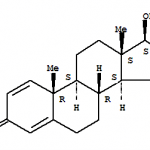
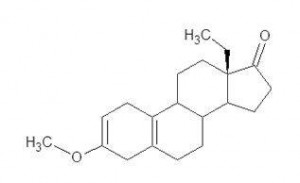
Il METHOXYGONADIENE è spesso commercializzato anche come methoxydienone, Max-LMG, LMG, M-LMG
18-methyl-3-methoxy-estra-2,5(10)-dien-17-one or 13β-ethyl-3-methoxy-gona-2,5(10)-dien-17-one
 Questo composto fu brevettato nel 1960 dai laboratori Wyeth, assieme ad altri derivati 13-alchilati del nandrolone, inclusa la prima pillola contraccettiva, il Levonergestrel. Il Methoxy è facilmente convertibile nel suo derivato Norboletone, da cui è probaile che derivi buona parte dell’azione biologica: un’altra molecola patentata originariamente Wyeth e poi divenuta famosa come CLEAR, quello dello scandalo Balco, il primo designer steroid a diventare famoso per aver gabbato per anni o decenni il test antidoping WADA.
Questo composto fu brevettato nel 1960 dai laboratori Wyeth, assieme ad altri derivati 13-alchilati del nandrolone, inclusa la prima pillola contraccettiva, il Levonergestrel. Il Methoxy è facilmente convertibile nel suo derivato Norboletone, da cui è probaile che derivi buona parte dell’azione biologica: un’altra molecola patentata originariamente Wyeth e poi divenuta famosa come CLEAR, quello dello scandalo Balco, il primo designer steroid a diventare famoso per aver gabbato per anni o decenni il test antidoping WADA.
Già nello stomaco, il gruppo metoxile in C-3 e rapidamente sciolto della acidità gastrica, come pure viene rotto il doppio legame sull’anello A in C-2. Questo processo biochimico lascia il posto al metabolita 13b-ethyl-nor-androstenedione, che è la vera forma bio-attiva del Methoxygonadiene, che poi a sua volta può venire convertita a livello epatico a Norboletone
Si tratta di uno steroide molto potente ( 90 androgeno/ 625 anabolico rispetto al Nandrolone 100/100, il che vorrebbe dire qualcosa come 25 anabolico 750 androgeno sul testosterone) con un indice terapeutico estremamente favorevole (30), questo per via iniettabile, mentre mancano dati sulla sua efficacia orale; è probabile comunque che la sua biodisponibilità orale sia circa del 50%, confrontando i dati del levogestrel (diretto analogo), similmente 18beta etilato,e con quelli del diretto successore metabolico, il norboletone (17 androgeno/ 350 anabolico sul metiltestosterone)
La funzionalità di questa molecola rimane comunque largamente incompresa da molti utilizzatori, in buona parte anche per l’opera di disinformazione operata dalla ALRI al suo lancio come integratore alimentare: secondo la pubblicità (mascherata da informazioni tecniche) il LMG (Lean Mass Generator) avrebbe dovutto essere strutturalmente correlato alla pillola abortiva RU-486, che sarebbe un potente agente anticortisolemico e antiprogestinico: in realtà il Methoxygonadiene è una molecola decisamente differente dalla RU-486 e molto più simile all’ anticoncezionale Levogetrel; così mentre l’azione anticortisolemica è in parte (indirettamente) reale tramite la sua affinità inversa per i recettori del cortisolo (similmente al trenbolone), quella antiprogestativa è un favola, essendo l’affinità del LMG ai recettori del progesterone in parte diretta. Quindi il Methoxygonadiene ha una forte azione prolattinica: garantiti deca-dick e aromatizzazione della molecola stessa nonché dei composti co-somministrati, esattamente l’opposto di quello preteso dalla ALRI. Allo stesso modo l’affermazione secondo cui il LMG sarebbe 5-alfa ridotta e quindi non convertbile a DHT ma analoga di questo (e non aromatizzabile): il Methoxygonadiene non è 5-alfa ridotto e neanche solo remotamente riconducibile al DHT; avendo un doppio legame in C5-C10, convertibile nell’organismo ad uno stabile legame in C4-C5 (il DHT è invece proprio T senza doppio legame in C4-C5). Questo rende il LMG un anabolizzante tipicamente MIX e aromatizzabile.
Riassumendo, abbiamo un’anabolizante di notevole potenza e poco androgenico, ma molto “bagnato”con una tossicità epatica contenuta, adatto quindi all’uso femminile ed in bulk, con caratteristiche recettoriali che ben lo accappiano sia con trenbone, tre-stolone ed altri AR affini come i metil derivati del drostanolone, sia con il testosterone per potenziarne anche l’attività estrogenica. L’attività antigonadale è molto spiccata, per cui meglio il composto si adatta alla tattica dei mini-blitz o al bridging, risultando con questa molecola meno che mai gestibile l’abituale pratica dei cicli di 8-12 settimane seguiti da PCT e speranzoso periodo di recupero.
Pietro Sassi
Bibliografia
[1] US Patent US3959322: Synthesis of 13-alkyl-gon-4-ones. Smith, Herchel
[2] US Patent US3547909: Hughes GA. Synthesis of Gona-2,5(10)-Dienes. 1970.
[3] Herchel Smith Biography – University of Cambridge
[4] Buzby GC, Walk CR, Smith H. Totally Synthetic Steroid Hormones. X. Some (±)-13β-Ethyl-7α-methylgonane Derivatives. J. Med. Chem. 1966 Sep 1;9(5):782–4.
[5] Biological effects of synthetic gonanes. Edgren RA, Peterson DL, Jones RC, Nagra CL, Smith H, Hughes GA. Recent Prog Horm Res. 1966;22:305-49.
[6] Nomenclature of the gonane progestins. Edgren RA, Stanczyk FZ. Contraception. 1999 Dec;60(6):313
________________

Quest’opera è distribuita con Licenza Creative Commons Attribuzione – Non commerciale – Non opere derivate 3.0 Italia.