Iscrivi alla nostra Newsletter qui per essere sempre aggiornato sulle ultime pubblicazioni e sugli sconti speciali presso i nostri partners 😀
∼∼∼∼∼∼∼∼∼∼∼
Il Fluoxymesterone o fluossimesterone [9-fluoro-11,17-dihydroxy-10,13,17-trimethyl-1,2,6,7,8,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-3-one], noto anche con il nome commerciale di Halotestin®, è uno steroide anabolizzante derivato del Testosterone.
La sua storia è legata alla Upjohn (o The Upjohn Company), una public Company con sede a Kalamazoo nello stato del Michigan in USA, fondata nel 1886 dal Dr. William E. Upjohn e tre suoi fratelli. Essa è stata una delle più grandi produttrici di innovativi farmaci etici degli Stati Uniti.
Il team di ricercatori Upjohn iniziò una serie di studi sul potenziale degli steroidi anabolizzanti in seguito all’osservazione di ampi trial clinici sul “deponortestonato” (prodotto della Upjohn contenente Nandrolone iniettabile) con lo scopo di sviluppare e testare una serie di nuove molecole.
Una delle scoperte più significative del team Upjohn è stata fatta nel 1950, quando scoprirono una tecnica di fermentazione microbiologica per l’introduzione di un atomo di ossigeno nell’11° atomo di carbonio di uno steroide[1]. Ciò non permise solo l’introduzione su larga scala di composti corticosteroidei, come il Cortisone, ma aprì la strada anche alla creazione del Fluoxymesterone.
I risultati degli esperimenti sui ratti trattati con alcuni steroidi 11-ossigenati sintetizzati dalla Upjohn si possono osservare nella seguente tabella[2]:
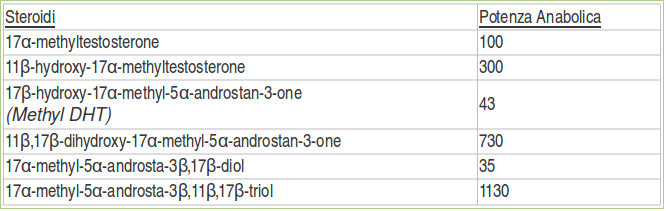
Come si può vedere dalla tabella, tutti gli steroidi 11-ossigenati sono risultati significativamente più potenti rispetto alle loro controparti non-ossigenate.
Derivati corticosteroidei 9α-alogenati sono stati descritti da Fried e Sabo nel 1953 ed è stata osservata una maggiore attività glucocorticoide e anti-infiammatoria[3]. Con questo in mente, Lyster et al. alla Upjohn sintetizzarono e testarono una serie di derivati del testosterone 11β-idrossilati e 9α-alogenati[4].
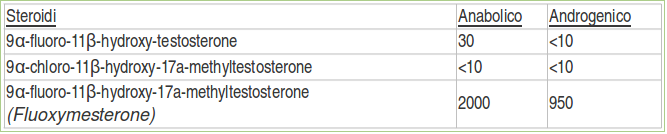
Essi scoprirono che la soppressione dell’attività del gruppo 9-cloro, e la sostituzione 9α-fluoro nello steroide produceva un notevole aumento dell’attività anabolizzante e androgena per via orale nei ratti[4]:
“l’11β-idrossi-methyltestosterone è 0,9 volte più androgeno e 3 volte più anabolico del Methyltestosterone. Il 9-Fluoro-11β-idrossi-methyltestosterone è 9,5 volte più androgeno e 20 volte più anabolico del Methyltestosterone”
Il composto 9α-fluoro 11β-hydroxy 17α-methyltestosterone è stato successivamente denominato Fluoxymesterone.
I ricercatori della Upjohn classificarono il potere Anabolizzante:Androgeno del Fluoxymesterone somministrato oralmente a 2000:950 rispetto al Metiltestosterone.[4]
I dati sono stati successivamente riportati dalla Upjohn nel 1963 dai ricercatori Kincl e Dorfman della Syntex che confermarono rispettivamente i dati sul levator ani, vescicole seminali, e prostata ventrale al 1745%, 757% e 118% (quest’ultimi due come indici androgenici).[5]
![Il rapporto A:A dello Stanozololo non appare così favorevole dalle analisi della Upjohn del 1965.[8]](http://bbhit.altervista.org/wp-content/uploads/2016/03/fluoxymesterone-stanazolol-320x316.png)
Naturalmente le loro conclusioni potrebbero essere state alquanto “edulcorate” dalla loro posizione commerciale; come ricercatori della Sterling-Winthrop erano responsabili della creazione dello steroide Stanozololo (Winstrol).[7]
Struttura molecolare del Fluoxymesterone
Il Fluoxymesterone è strutturalmente classificato come un derivato alogenato del Testosterone. Il gruppo alogeno aggiunto è quello di fluoro in C-9, che ne potenzia l’attività androgena, rendendo la molecola un substrato migliore per la 5α-riduzione, con produzione di metaboliti estremamente androgeni. Mentre la modifica in C-9 è un’anomalia nel mondo degli androgeni, questa è relativamente comune tra i glucocorticoidi sintetici; come
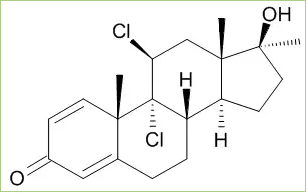
nel Desametasone, Betametasone, Fludrocortisone, e Triamcinolone. In realtà ci sono alcuni composti che vengono sostituiti in C-9 con altri alogeni. Ad esempio, il Beclometasone ha una funzione 9α-cloro. La Schering testò alcuni composti 9α, 11β- alogenati, con scarso successo, anche se clorurati derivati dal Dianabol hanno mostrato di essere promettenti come anabolizzanti, con rapporto 300:60 rispetto al Metiltestosterone con somministrazione orale.[9]
Non è del tutto chiaro il motivo per cui la frazione 9α-fluoro conferisce un’elevata attività anabolizzante/androgena al Fluoxymesterone somministrato oralmente, ma l’atomo di fluoro può potenzialmente cambiare la farmacocinetica e la farmacodinamica di un composto in diversi modi:
“1. Il Fluoro, a causa delle sue ridotte dimensioni steriche, assomiglia all’idrogeno bioattivo rispetto all’ambiente sterico in associazione con le regioni proteina recettore;
2. Il Fluoro, l’elemento più elettronegativo, altera gli effetti elettronici;
3. Il Fluoro, quando legato al carbonio ha una energia di legame carbonio-fluoro pari a 107 kcal / mol, aumenta l’ossidabilità, la temperatura e la stabilità metabolica; e
4. Forse ancora più importante, il legami carbonio-fluoro aumenta notevolmente la solubilità dei lipidi e, quindi, migliora i tassi di bio-assorbimento e bio-transporto.”[10]
In conformità con la prima proprietà di cui sopra, l’atomo di fluoro ha un raggio di van der Waals molto simile all’atomo di idrogeno che sostituisce, il raggio standard dell’idrogeno si trova a circa 1.1Å-1.2Å e per il fluoro circa 1.35Å-1.47Å.[11][12][13]
Oltre al suo insolito gruppo 9α-fluoro, il Fluoxymesterone possiede anche un gruppo 11β-idrossile, che è caratteristico di molti corticosteroidi attivi. Un recente studio ha scoperto che a causa della presenza del gruppo 11β-idrossile il Fluoxymesterone interferisce con il metabolismo dei corticosteroidi. Il Cortisolo viene convertito in Cortisone inattivo da parte dell’enzima 11β-idrossisteroide deidrogenasi di tipo 2 (11β-HSD-2). Poiché il recettore mineralcorticoide (MR) può essere attivato sia dai mineralcorticoidi che dai glucocorticoidi, questo enzima è espresso nei tessuti mineralcorticoidi sensibili per impedire l’attivazione del MR da parte del Cortisolo. Il Fluoxymesterone è risultato essere un potente inibitore competitivo della 11β-HSD-2 umana.[14]
Questa inibizione potrebbe causare una attivazione dei MR cortisolo-indotta, che può condurre alla ritenzione di sodio e all’escrezione di potassio, causando ritenzione idrica e ipertensione.
Dopo li successivo uso clinico del Fluoxymesterone, sono state apportate alcune variazioni: sono stati sintetizzati composti 16α-metilati da Merck, anche se sono risultati deludenti al confronto.[15]
L’11-keto, analogo del Fluoxymesterone, rispetto a quest’ultimo è leggermente più anabolizzante (22 vs 20) e meno androgeno (8,5 vs 9,5).[16]
Metabolismo del Fluoxymesterone
Nonostante le modifiche 9α-fluoro e 11β-idrossile, il Fluoxymesterone subisce sia la 5α-riduzione che la 5β-riduzione negli esseri umani[17], i 3-cheto metaboliti ridotti sono stati rilevati anche nell’uomo.[17][18]
Nonostante il 9α-fluoro-testosterone aromatizza circa la metà del Testosterone, il gruppo 11β-idrossile del Fluoxymesterone ne impedisce l’aromatizzazione e anche l’affinità di legame con le SHBG.[19][20]
“La presenza di sostituenti assiali in posizione C-11 interferisce con l’aromatizzazione dell’anello A”[19]
Come con tutti i 17α-alchil-17b-idrossi steroidi, i metaboliti 17-cheto del Fluoxymesterone sono impossibili. La 17-epimerizzazione del Fluoxymesterone è stata segnalata ed è una comune (anche se minore) via metabolica tra 17α-metil-17β-idrossi steroidi.[21]
La presenza di diversi metaboliti idrossilati, diidrossilati, 11,12 e 13,14 insaturi, e 11-cheto sono stati identificati (post-somministrazione) anche negli esseri umani, secondo un recente studio.[17]
E’ anche interessante notare che il Fluoxymesterone viene metabolizzato al suo corrispondente analogo 11-cheto (11-oxo Fluoxymesterone) dalla 11β-HSD-2 umana (anche se non ampiamente), come dimostrato da un esperimento in vitro contemporaneo.
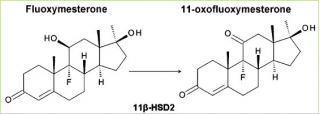
“Dati biologici hanno mostrato che il Fluoxymesterone è un substrato del 11β-HSD-2, ma con un tasso di conversione inferiore al Cortisolo.”[14]
L’ultima differenza rispetto al Testosterone è la 17-alfa-metilazione, che ovviamente lo rende tossico per il fegato (alcune evidenze mostrano una marcata tossicità).
La sua capacità inibitiva sull’HPTA è più marcata di quella esercitata dal Metilltestosterone, nonostante non sia aromatizzabile, e si manifesta maggiormente a livello testicolare. Nel range dei 20mg/die non sembra mostrare un significativo impatto su FSH e LH ma già sul Testosterone circolante.
Il Fluoxymesterone possiede una biodisponibilità del 100%, dovuta alla metilazione in posizione 17α la quale inibisce il metabolismo epatico per ossidazione enzimatica del 17β-idrossile, consentendo l’assorbimento nel flusso sanguigno della molecola.
Come molti altri steroidi metilati in C-17, il Fluoxymesterone presenta una scarsa affinità con i recettori AR, ciononostante le sue azioni sono mediate dal recettore degli androgeni, molto probabilmente a causa della sua prolungata emivita plasmatica che è di circa 9,2 ore.[22]
Uso clinico del Fluoxymesterone
Il Fluoxymesterone viene applicato in ambito medico per il trattamento del’ipogonadismo maschile, il ritardo della pubertà nei maschi, e nel trattamento di neoplasie al seno nelle donne. L’attività antitumorale del Fluoxymesterone appare correlata alla riduzione o inibizione competitiva dei recettori della prolattina o dei recettori estrogeni o dell’inibita produzione di questi.
Applicazione nelle preparazioni atletiche
Date le prima citate caratteristiche, il Fluoxymesterone è stato per un lungo periodo di tempo utilizzato in ambito Culturistico e nel Powerlifting. Nel BodyBuilding questo AAS ha visto il suo più largo uso nelle 4-6 settimane precedenti alla gara in abbinamento con una dieta adeguata, grazie alla sua capacità di migliorare la consistenza muscolare e aumentare l’attività mentale (aggressività, resistenza al dolore e alla fatica). Poiché questo farmaco non aromatizza e raramente il suo uso causa ritenzione idrica, funziona piuttosto bene per questo scopo. I powerlifters invece, interessati al forte potenziale androgeno del Fluoxymesterone, usano questa molecola prettamente per aumentare la forza e, di conseguenza, i carichi.
L’avvento degli inibitori dell’aromatase e la maggior disponibilità del Trenbolone hanno tolto parte dei vantaggi pratici derivanti dall’uso di questo prodotto (specie in pre-gara), ma grazie alla sua scarsa affinità per i recettori androgeni (AR) mantiene ancora una certa popolarità in pre-gara e nei cicli di forza in associazione con prodotti spiccatamente affini per i recettori androgeni come il Trenbolone.
Con il dilagare del fenomeno “Crossfit”, il Fluoxymesterone ha trovato una nuova applicazione sportiva oltre alle prima citate categorie (Bodybuilder e Powerlifter). Infatti, questo AAS si presta perfettamente a questa disciplina fornendo all’atleta una maggiore forza, concentrazione e resistenza mentale e fisica. Dal grande potenziale per gli atleti avanzati è lo “stack” Fluoxymesterone, Trenbolone e GW1516.
I dosaggi di Fluoxymesterone mediamente usati dagli atleti di sesso maschile sono tra i 20-40mg/die per un periodo compreso tra le 3 e le 6 settimane; il dosaggio viene diviso in 2-3 assunzioni eguali al giorno. Dati i suoi effetti collaterali a carico del fegato, la sua assunzione non dovrebbe mai superare le 6 settimane totali.
La sua reperibilità nel mercato nero non è così grande, e la presenza di prodotti contenenti altra o nessuna molecola e spacciati per Fluoxymesterone non è una rarità.
Gli effetti collaterali che il Fluoxymesterone può portare comprendono cefalea, nervosismo, ansia, oligospermia, iperattività sessuale, atrofia testicolare, carcinoma epatico, alterazione dei lipidi ematici e alopecia.
Conclusioni
Per concludere vorrei sottolineare il fatto che questa molecola non è adatta ai principianti (con meno di 2 cicli ben fatti alle spalle) ed ai soggetti sensibili a livello psicologico. Non abbinare mai il Fluoxymesterone e il Trenbolone prima di aver testato la tollerabilità singola di ognuna di queste due molecole. Il “fai da te” è come al solito caldamente sconsigliato.
Per gli agonisti è importante sapere che il tempo di rilevabilità del Fluoxymesterone nei test anti-doping è di 2 mesi.
Gabriel Bellizzi
Riferimenti scientifici
1. Hogg JA., Steroids, the steroid community, and Upjohn in perspective: a profile of innovation. Steroids 1992 Dec;57(12):593-616.
2. Martini L., Pecile A., Hormonal Steroids Vol. 2, pp. 59-67. New York: Academy Press 1965
3. Fried J., Sabo EF., Synthesis of 17α-hydroxycorticosterone and its 9α-halo derivates from 11-epi-17α-hydroxycorticosterone. J. Am. Chem. Soc., 1953, 75 (9), pp 2273–2274
4. Lyster et al., Androgenic and myotrophic properties of orally administered 9-FLUORO-Il-OXY-METHYLTESTOSTERONES. Endocrinology Vol. 58, pp. 781-785 1956
5. Dorfman RI., Kincl FA., Relative Potency of Various Steroids in an Anabolic-Androgenic Assay Using the Castrated Rat. Endocrinology Vol. 72(2):259-266 1963.
6. Beyler et al., The ratio of anabolic to androgenic activity of 7:17-dimethyltestosterone, oxymesterone, mestanolone and fluoxymesterone. J Endocrinol December 1, 1963 28 87-92.
7. Beyler et al., Influence of molecular unsaturation on hormonal activity pattern ofcertain heterocyclic steroids. Endocrinology Vol. 68(6), pp. 987-995 1961.
8. Proc. 1st Int. Congr. Hormonal Steroids Vol. 2, pp. 119-132. New York: Academic Press, 1965.
9. Robinson et al., New Anabolic Agents: 9α,11β-Dihalogenoandrostane Derivatives. J. Am. Chem. Soc., 1960, 82 (17), pp 4611–4615.
10. Patrick TB., Fluoro-organic biochemistry. Journal of Chemical Education, vol. 56(4) p. 228, 1979.
11. Vida JA., Androgens and anabolic agents; chemistry and pharmacology. New York: Academic Press, 1969, p.63.
12. Bondi A., van der Waals Volumes and Radii. J. Phys. Chem., 1964, 68 (3), pp 441–451
13. Rowland RS., Taylor R., Intermolecular Nonbonded Contact Distances in Organic Crystal Structures: Comparison with Distances Expected from van der Waals Radii. J. Phys. Chem., 1996, 100 (18), pp 7384–7391.
14. Fürstenberger et al., The anabolic androgenic steroid fluoxymesterone inhibits 11β-hydroxysteroid dehydrogenase 2-dependent glucocorticoid inactivation. Toxicol Sci. 2012 Apr;126(2):353-61.
15. Fried et al., 16-Methylated Steroids. III. The Synthesis of 9α – Fluoro -16α,17α- dimethyl -4- androstene-11β,17β-diol-3-one. J. Org. Chem., 1962, 27(2), pp. 682–684.
16. Hogg et al., Synthesis of potent oral anabolic-androgenic steroids. J. Am. Chem. Soc., 1956, 78 (2), pp 500–501
17. Lu et al., Mass spectrometric identification and characterization of new fluoxymesterone metabolites in human urine by liquid chromatography time-of-flight tandem mass spectrometry. Steroids. 2012 Jul; Vol. 77(8-9):871-877.
18. Kammerer et al., Testing for fluoxymesterone (Halotestin®) administration to man: Identification of urinary metabolites by gas chromatography-mass spectrometry. J Steroid Biochem. 1990 Aug 28; Vol. 36(6):659-66.
19. Dorfman et al., Biosynthesis of Estrogens. Endocrinology. 1962 Dec; Vol. 71:920-925.
20. Knudsen JF., Max SR., Aromatization of androgens to estrogens mediates increased activity of glucose 6-phosphate dehydrogenase in rat levator ani muscle. Endocrinology. 1980 Feb; Vol. 106(2):440-443.
21. Schänzer et al., 17-Epimerization of 17 alpha-methyl anabolic steroids in humans: metabolism and synthesis of 17 alpha-hydroxy-17 beta-methyl steroids. Steroids. 1992 Nov; Vol. 57(11):537-550.
22. Seth Roberts “Anabolic Pharmacology”. 2009
________________
Quest’opera è distribuita con Licenza Creative Commons Attribuzione – Non commerciale – Non opere derivate 3.0 Italia.