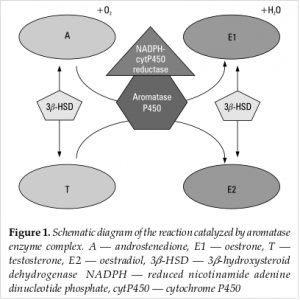
 L’aromatasi è un enzima della famiglia del citocromo P450, la sua funzione è catalizzare una complessa sequenza di reazioni che portano alla formazione di estradiolo ed estrone dal testosterone e dall’androstenedione. Tale enzima viene espresso in molti tipi di cellule: osteoblasti, condrociti, osteociti, fibroblasti e preadipociti, neuroni, cellule della granulosa, di Leydig e del Sertoli, ecc e dunque in molti altri tessuti (oltre alle gonadi) troviamo questo enzima, su i quali poi gli estrogeni si legano per mezzo dei rispettivi recettori per esplicare la loro funzione. Durante l’età fertile nella donna, l’aromatasi viene prevalentemente espresso nelle ovaie subendo poi una riduzione durante la menopausa dove verrà maggiormente espresso dagli altri tessuti (soprattutto nella mammella); stessa cosa avviene nell’uomo dove l’85% dell’estradiolo e il 90% dell’estrone verrà prodotto a livello dei tessuti periferici partendo dagli androgeni (testosterone ed androstenedione) circolanti, causandone un calo. C’è da fare una considerazione in merito, gran parte degli estrogeni prodotti a livello extragonadale (dunque da parte degli altri tessuti in cui viene espresso l’aromatasi) non esplicheranno la loro funzione a livello sistemico bensì in modo autocrino, paracrino o giustacrino coinvolgendo le stesse cellule e/o quelle vicine.
L’aromatasi è un enzima della famiglia del citocromo P450, la sua funzione è catalizzare una complessa sequenza di reazioni che portano alla formazione di estradiolo ed estrone dal testosterone e dall’androstenedione. Tale enzima viene espresso in molti tipi di cellule: osteoblasti, condrociti, osteociti, fibroblasti e preadipociti, neuroni, cellule della granulosa, di Leydig e del Sertoli, ecc e dunque in molti altri tessuti (oltre alle gonadi) troviamo questo enzima, su i quali poi gli estrogeni si legano per mezzo dei rispettivi recettori per esplicare la loro funzione. Durante l’età fertile nella donna, l’aromatasi viene prevalentemente espresso nelle ovaie subendo poi una riduzione durante la menopausa dove verrà maggiormente espresso dagli altri tessuti (soprattutto nella mammella); stessa cosa avviene nell’uomo dove l’85% dell’estradiolo e il 90% dell’estrone verrà prodotto a livello dei tessuti periferici partendo dagli androgeni (testosterone ed androstenedione) circolanti, causandone un calo. C’è da fare una considerazione in merito, gran parte degli estrogeni prodotti a livello extragonadale (dunque da parte degli altri tessuti in cui viene espresso l’aromatasi) non esplicheranno la loro funzione a livello sistemico bensì in modo autocrino, paracrino o giustacrino coinvolgendo le stesse cellule e/o quelle vicine.
Alcuni fattori possono far aumentare l’espressione dell’aromatasi attraverso vari sistemi: ad esempio il cancro al seno iperesprime le COX-2 che aumentano la conversione dell’acido arachidonico in PGH-2 che a loro volta verranno converitite in PGE-2, quest’ultime sono potenti stimolatori dell’aromatasi; si innesca insomma un circolo vizioso. Infatti gli inibitori delle COX-2 hanno mostrato di interferire con questo processo inibendo l’attività aromatasica delle cellule cancerose. Questi inibitori vengono usati per ridurre lo stato infiammatorio in virtù proprio della loro maggiore selettiva.
Deficit dell’aromatasi
Questa patologia è un raro disordine autosomico recessivo riscontrato in poche decine di casi documentati, si tratta della risultante di una serie di mutazioni sul tratto codificante del gene CYP19A1 che porta alla riduzione o alla perdita della funzionalità di questo enzima e dunque all’assenza di estrogeni.
Su modello animale la deficienza aromatasica ha fatto emerge inaspettate funzioni degli estrogeni (in maschi e femmine) che non fossero correlate solo all’aspetto riproduttivo. I ratti modificati geneticamente in cui l’aromatasi è stato disattivato, fenotipicamente mostravano un accumulo eccessivo di grasso intraddominale con obesità che progrediva con l’età ed inoltre aumento dei lipidi circolanti e iperinsulinemia dovuta all’insulino resistenza, nonchè perdita della densità minerale ossea; nei soggetti maschili si è osservata anche steatosi epatica, reversibile con la somministrazione di β-estradiolo. A livello riproduttivo invece i soggetti femminili presentavano infertilità dovuta ad anovulazione e degenerazione delle ovaie con numerosi cisti emorragiche nei follicoli e sottosviluppo uterino; nei maschi invece l’infertitlità era causata dall’interruzione della spermatogenesi e da un comportamento sessuale alterato.
Negli umani (a partire dai pochi casi conosciuti) i sintomi di questa deficienza compaiono prima della nascita in donne incinte soggette ad una progressiva virilizzazione causata dall’incapacità di aromatizzare gli androgeni prodotti dalla placenta; questo eccessivo livello di androgeni nell’utero porta alla virilizzazione dei feti femminili in cui saranno presenti alla nascita entrambi i caratteri sessuali, e dunque in tutti i casi di pseudoermafroditismo fenotipico si prende in considerazione come possibile causa una deficienza sull’espressione dell’aromatasi. Durante l’infanzia potrebbero manifestarsi cisti ovariche emorragiche, mentre durante la pubertà pur essendoci un adrenarca normale si presenta amenorrea primaria e mancanza di sviluppo del seno; da semplici test ormonali è facile scoprire l’ipogonadismo ipergonadotropico associato ad iperandrogenismo. Questo eccesso di ormoni androgeni porta alla manifestazione di acne e irsutismo che peggiora con l’età, inoltre per mancanza di estrogeni non avverrà la saldatura delle epifisi ossee ma la diminuzione della densità minerale con osteoporosi precoce.
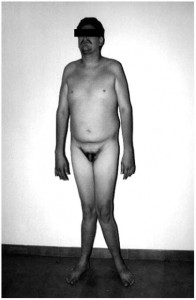 Nei maschi invece i sintomi della deficienza di aromatasi compaiono dopo la pubertà e consistono in una crescita progressiva lineare anche in età adulta dovuta proprio alla mancanza di estrogeni, il che impedisce la saldatura delle epifisi al di là dei relativi alti livelli di testosterone; saranno presenti ginocchia valghe, fisico eunucoide, osteopenia ed esteoporosi, obesità, sindrome metabolica, dislipidemia, iperinsulinemia (che porta a insulino resistenza e diabete con l’avanzare dell’età), acantosi nigricans, possibile steatosi epatica, problemi di fertilità, libido e criptorchidismo. Si riscontrano alti livelli di FSH ed LH, estradiolo ed estrone assenti ma testosterone ed androstenedione nella norma o poco al di sopra, il che sta ad indicare che sono gli estrogeni che innescano il feedback negativo a livello ipofisario ma anche ipotalamico (leggi anche Clomifene e fisiopatologia HPTA). Il fenotipo del deficit dell’aromatasi è simile a quello riscontrabile nella mutazione che inattiva gli ER-α (e che portano all’estrogeno resistenza), ma nel primo caso una terapia a base di estrogeni ha migliorato il quadro clinico aumentando la densità ossea, saldando le epifisi, e in alcuni casi migliorando anche i lipidi ematici, l’insulino resistenza, la tolleranza al glucosio e la steatosi epatica.
Nei maschi invece i sintomi della deficienza di aromatasi compaiono dopo la pubertà e consistono in una crescita progressiva lineare anche in età adulta dovuta proprio alla mancanza di estrogeni, il che impedisce la saldatura delle epifisi al di là dei relativi alti livelli di testosterone; saranno presenti ginocchia valghe, fisico eunucoide, osteopenia ed esteoporosi, obesità, sindrome metabolica, dislipidemia, iperinsulinemia (che porta a insulino resistenza e diabete con l’avanzare dell’età), acantosi nigricans, possibile steatosi epatica, problemi di fertilità, libido e criptorchidismo. Si riscontrano alti livelli di FSH ed LH, estradiolo ed estrone assenti ma testosterone ed androstenedione nella norma o poco al di sopra, il che sta ad indicare che sono gli estrogeni che innescano il feedback negativo a livello ipofisario ma anche ipotalamico (leggi anche Clomifene e fisiopatologia HPTA). Il fenotipo del deficit dell’aromatasi è simile a quello riscontrabile nella mutazione che inattiva gli ER-α (e che portano all’estrogeno resistenza), ma nel primo caso una terapia a base di estrogeni ha migliorato il quadro clinico aumentando la densità ossea, saldando le epifisi, e in alcuni casi migliorando anche i lipidi ematici, l’insulino resistenza, la tolleranza al glucosio e la steatosi epatica.
Come si può ben capire contrariamente a quanto si pensava, non è il testosterone in se il responsabile della saldatura delle epifisi ossee e nemmeno della perdita di densità minerale ossea; bensì gli estrogeni rivestono un ruolo di rilievo in questo senso. Nei maschi un ruolo ugualmente importante è occupato dal DHT (diidrotestosterone) per quanto riguarda la saldatura delle epifisi e soprattutto il mantenimento della densità ossea, difatti su quest’ultimo aspetto è stato visto che nei maschi osteoporotici il DHT, IGF-1, IGF-2 e IGFBP-3 erano molto bassi contrariamente ai marker del turnover osseo rispetto ai soggetti sani, mentre gli altri valori quali PTH, testosterone, estradiolo, IGFBP-4, TNF-alfa, IFN-gamma sono simili tra i due gruppi. La differenza dei livelli di DHT tra i due gruppi è risultata (al di la delle classi d’età) omogenea, segno del fatto che sussiste una forte correlazione fra DHT e mantenimento della densità minerale ossea il che apre ulteriori nuovi scenari sull’utilizzo di androgeni non aromatizzabili (quelli derivati dal DHT ad esempio) nella cura dell’osteoporosi maschile.
È stata completamente rivoluzionata l’idea che gli estrogeni fossero importanti solo nelle donne mentre il testosterone nei maschi per la salute dell’apparato scheletrico, quando invece i recettori degli estrogeni (e ancor prima l’espressione dell’aromatasi) li troviamo sulle cellule dell’osso (tranne negli osteoclasti) in entrambi i sessi. Nei maschi anziani viene sottovalutata l’incidenza dell’osteoporosi, ma sul totale dei casi di fratture per osteoporosi ben il 39% sono avvenuti nei maschi; inoltre anche il tasso di mortalità è più alto rispetto alle donne.
Il livello degli estrogeni nell’uomo risulta essere superiore rispetto alla controparte femminile, come già detto l’85% provengono dalla conversione periferica e a livello osseo hanno funzione paracrina ed intracrina riducendo l’apoptosi e lo stress ossidativo negli osteoblasti ma aumentando quella degli osteoclasti.
Difatti in tutti i casi di resistenza estrogenica e in misura maggiore deficit dell’aromatasi, sono stati osservati parziali o incomplete saldature delle epifisi ed osteoporosi, risoltesi in seguito a terapia sostitutiva a base di estrogeni.
Iperespressione dell’aromatasi
Oltre al deficit di aromatasi, troviamo anche la problematica opposta ossia un eccesso di aromatasi. C’è da fare sempre una dovuta distinzione, poichè l’eccesso di aromatasi a livello locale (dovuto ad esempio ad alcuni tumori) non influenza più di tanto i livelli di estrogeni circolanti, anche se a livello della mammella ad esempio un aumento dell’aromatasi porterà inevitabilmente a ginecomastia prepuberale. Solitamente i livelli estrogenici elevati a livello locale difficilmente sono misurabili, proprio perchè come è stato detto gli estrogeni prodotti a livello dei tessuti periferici non entrano in circolo (buona parte almeno) ma esplicano azione paracrina e intracrina il che porta inevitabilmente a situazioni di estrogeno dipendenza a livello dei tessuti in cui sussiste iperespressione dell’aromatasi come nel caso del cancro al seno o all’endometrio, ginecomastia, endometriosi, ecc; dunque i livelli circolanti di estrogeni potrebbero anche rientrare nei range, ma a livello di quei tessuti invece si troveranno in concentrazione maggiore, ecco spiegato anche il motivo per cui alcuni soggetti presentano ginecomastia pur avendo i livelli di estrogeni ed androgeni perfettamente nella norma. Sussistono delle condizioni patologiche che incrementano l’attività dell’aromatasi, quale la vecchiaia, l’obesità, l’ipertiroidismo e poi una serie di tumori quali al seno, ai testicoli, alle surrenali, alla pelle, ecc.
Inibitori dell’aromatasi
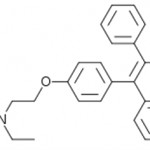
Degli inibitori dell’aromatasi se ne è parlato anche in questo articolo (Antiestrogeni e bodybuilding), ad ogni modo ripercorrendo le tappe che hanno portato alla loro creazione quale presidio farmacologico contro l’iperespressione dell’aromatasi, troviamo che agli inizi la terapia chirurgica rappresentava l’unico modo per contrastarne gli effetti. Più di un secolo fa venivano rimosse sia le tube di Falloppio che le ovaie nei casi di cancro al seno avanzato, successivamente l’ipofisectomia e l’adrenalectomia (dapprima chirurgica e poi farmacologica); successivamente intorno agli anni 70 entrano in scena i SERM con il tamoxifene, e gli inibitori dell’aromatasi appunto. Come si sarà ben capito, quest’ultimi cessano la produzione di estrogeni inibendo la conversione dagli androgeni; vengono usati nei casi in cui il tumore al seno presenta recettori degli estrogeni, poichè gli estrogeni prodotti a livello locale o dalle cellule adiacenti possono stimolare la proliferazione delle cellule tumorali. Il primo inibitore dell’aromatasi fu l’Aminoglutetimide, il quale venne usato per inibire la steroidogenesi surrenale ma successivamente si scoprì che bloccava in tutto il corpo l’aromatasi, configurandosi come un inibitore non selettivo di prima generazione (insieme al testolattone) che presentava pesanti effetti collaterali e dunque rimpiazzato dal tamoxifene. Quest’ultimo si dimostrò essere abbastanza valido rispetto all’aminoglutetimide e venne usato come presidio primario contro il cancro al seno. Successivamente nacquero gli inibitori selettivi dell’aromatasi (o di seconda generazione), il primo fu il Formestane di natura steroidea usato come secondo presidio dopo il tamoxifene contro il cancro al seno, dagli effetti collaterali più miti rispetto a quelli di prima generazione. Dopo il Formestane nacque il Fadrozolo ma che non aveva natura steroidea, e rispetto al Formestane non si legava irreversibilmente all’aromatasi; si trattava del primo inibitore dell’aromatasi non suicida. Il suo ristretto utilizzo era dovuto purtroppo alla sua veloce eliminazione e alla forte inibizione sulla sintesi dell’aldosterone alle dosi utili per inibire l’aromatasi.
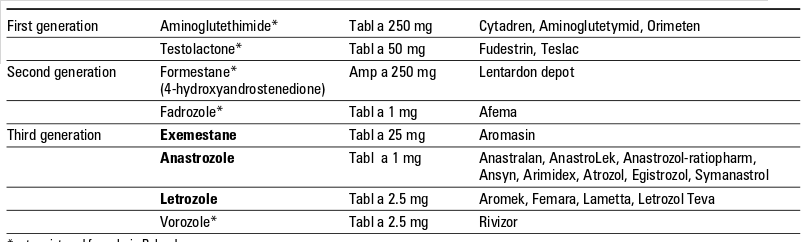
Negli anni 90 ultimi per ordine di scoperta troviamo gli inibitori di terza generazione, i più potenti e selettivi: exemestane (di natura steroidea, inibitore suicida), anastrozolo e letrozolo, molto più efficaci e meno tossici rispetto a quelli di prima e seconda generazione. Si stima che l’inibizione enzimatica possa arrivare al 97% (con il letrozolo), ed è stato dimostrato che siano anche più efficaci nel ridurre la massa tumorale rispetto al tamoxifene nel trattamento del cancro al seno (ma anche all’ovaio). I tipici effetti collaterali dei SERM superano quelli degli inibitori dell’aromatasi; il tamoxifene aumenta l’incidenza del cancro all’endometrio, inoltre aumenta il rischio di trombosi venosa profonda ed embolia polmonare. Con gli inibitori dell’aromatasi si è osservata un’accelerazione nella perdita di massa ossea ed osteoporosi, con incremento del rischio di fratture, atralgie e atrofia urogenitale, mentre problemi gastrointesinali, vampate di calore e cefalee possono essere presenti in entrambi. Sperimentalmente gli inibitori dell’aromatasi vengono impiegati anche per altri scopi terapeutici, quali ad esempio l’induzione dell’ovulazione (è il caso del letrozolo), endometriosi, nanismo, ed anche per la sindrome dell’ovaio policistico (letrozolo da solo o in coppia con il clomifene).
In ultimo volevo parlarvi di altre sostanze che sono in grado di ridurre l’espressione dell’aromatasi e i livelli di estrogeni, ad esempio è il caso della vitamina D (calcitriolo) che ha mostrato in vitro un’attività anti proliferativa sulle cellule cancerose del seno attraverso la downregolazione dell’espressione dei recettori α degli estrogeni (ER-α), oltre che l’inibizione dell’aromatasi a livello del tessuto adiposo mammario agendo da SAM (Selective Androgen Modulator), mostrando di funzionare nel trattamento dei tumori al seno estrogeno sensibili; i relativi alti dosaggi utili però ne limitano l’impiego per via della sua tossicità.
Un’altra sostanza (o per meglio dire “classe” di sostanze) è l’ostarina ma in generale i SARM, i quali hanno mostrato un’alta selettività tissutale realizzando il sogno clinico di dissociare gli effetti androgenici da quelli anabolizzanti, evitando soprattutto nelle donne gli spiacevoli effetti di virilizzazione. L’ostarina ha mostrato di funzionare bene in tal senso, soprattutto aumentando la densità minerale ossea e in minima parte anche la massa muscolare (più che altro in un contesto di ricomposizione corporea).
Anche il trenbolone ha mostrato una forte selettività nonchè come l’ostarina una grande forza di legame con i recettori androgeni (AR), esprimendo il suo potere anabolico anche attraverso l’alterazione dei fattori di crescita endogeni ed inibendo il potere catabolico dei glucocorticoidi (cortisolo in primis). Il fatto che il trenbolone venga convertito a metaboliti molto meno potenti di quelli del testosterone (ossia DHT ed estradiolo), lo rende un candidato ideale per combattere l’osteoporosi, la perdita di massa muscolare dovuta a sarcopenia, AIDS, cancro, ecc, ma anche contro l’obesità e il grasso ostinato.
Enzo McKloud
Iscriviti al gruppo di discussione su facebook Bodybuilding Revenge per partecipare alle discussioni 😉
Riferimenti Bibliografici
Kok-Yong Chin and Soelaiman Ima-Nirwana, Sex Steroids and Bone Health Status in Men. International Journal of Endocrinology, vol. 2012, Article ID 208719, 7 pages, 2012. DOI: 10.1155/2012/208719
E. Perel, D. Wilkins, D.W. Killinger, The conversion of androstenedione to estrone, estradiol, and testosterone in breast tissue. Journal of Steroid Biochemistry Volume 13, Issue 1, January 1980, Pages 89–94. DOI: 10.1016/0022-4731(80)90117-X
Izabella Czajka-Oraniec, Evan R. Simpson, Aromatase research and its clinical significance. Pol J Endocrinol 2010; 61 (1): 126–134. ISSN 0423–104X
Ilangovan R, Sittadjody S, Balaganesh M, Sivakumar R, Ravi Sankar B, Balasubramanian K, Srinivasan S, Subramanian C, Thompson DM, Queimado L, Srinivasan N, Dihydrotestosterone is a determinant of calcaneal bone mineral density in men. J Steroid Biochem Mol Biol. 2009 Nov;117(4-5):132-8. DOI: 10.1016/j.jsbmb.2009.08.004. Epub 2009 Sep 2.
Masomeh Hajishafiha, Meisam Dehghan, Nazila Kiarang, Nahideh Sadegh-Asadi, Seyed Navid Shayegh, and Mohammad Ghasemi-Rad, Combined letrozole and clomiphene versus letrozole and clomiphene alone in infertile patients with polycystic ovary syndrome. Drug Des Devel Ther. 2013; 7: 1427–1431. DOI: 10.2147/DDDT.S50972
Nahid L., Sirous K., Comparazione tra gli effetti del letrozolo e del clomifene citrato per l’induzione dell’ovulazione nelle donne infertili con sindrome dell’ovaio policistico. Minerva Ginecologica 2012 Giugno;64(3):253-8
Mohamed F.M Mitwally, Robert F Casper, Use of an aromatase inhibitor for induction of ovulation in patients with an inadequate response to clomiphene citrate. Fertility and Sterility Volume 75, Issue 2, Pages 305–309, February 2001. DOI: 10.1016/S0015-0282(00)01705-2
Lucia Gagliardi, Hamish S Scott, Jinghua Feng and David J Torpy, A case of Aromatase deficiency due to a novel CYP19A1 mutation. BMC Endocrine Disorders 2014, 14:16. DOI: 10.1186/1472-6823-14-16
Baykan EK., Erdoğan M., Özen S., Darcan Ş., Saygılı LF., Aromatase deficiency, a rare syndrome: case report. J Clin Res Pediatr Endocrinol. 2013;5(2):129-32. DOI: 10.4274/Jcrpe.970.
Hachidai Hirakawa, Yoshihito Yokoyama, Hidemi Yoshida and Hideki Mizunuma, Inhibitory effects of aromatase inhibitor on estrogen receptor-alpha positive ovarian cancer in mice. Journal of Ovarian Research 2014, 7:4. DOI: 10.1186/1757-2215-7-4
Bhasin S, Jasuja R., Selective Androgen Receptor Modulators (SARMs) as Function Promoting Therapies. Curr Opin Clin Nutr Metab Care. 2009 May;12(3):232-40. DOI:10.1097/MCO.0b013e32832a3d79
Yarrow JF, McCoy SC, Borst SE, Tissue selectivity and potential clinical applications of trenbolone (17beta-hydroxyestra-4,9,11-trien-3-one): A potent anabolic steroid with reduced androgenic and estrogenic activity. Steroids. 2010 Jun;75(6):377-89. DOI: 10.1016/j.steroids.2010.01.019. Epub 2010 Feb 4.
Srilatha Swami, Aruna V Krishnan, Lihong Peng, Johan Lundqvist and David Feldman, Transrepression of the estrogen receptor promoter by calcitriol in human breast cancer cells via two negative vitamin D response elements. Endocr Relat Cancer August 1, 2013 20 565-577. DOI: 10.1530/ERC-12-0281
________________

Quest’opera è distribuita con Licenza Creative Commons Attribuzione – Non commerciale – Non opere derivate 3.0 Italia.